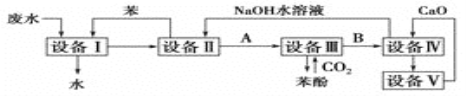
题目内容
【题目】A和B两种有机物可以互溶,有关性质如下:
物质 | 密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
A | 0.7893 | -117.3 | 78.5 | 与水以任意比混溶 |
B | 0.7137 | -116.6 | 34.5 | 不溶于水 |
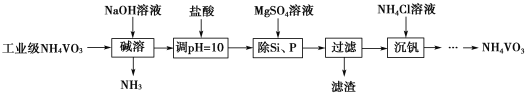
(1)要除去A和B的混合物中的少量B,可采用的_______________方法可得到A。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
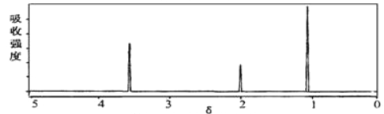
(2)将有机物A置于氧气流中充分燃烧,A和氧气恰好完全反应且消耗6.72L(标准状况)氧气,生成5.4gH2O和8.8gCO2,则该物质的实验式是__________;质谱图显示,A的相对分子质量为46,又已知有机物A的核磁共振氢谱如图所示,则A的结构简式为________________。
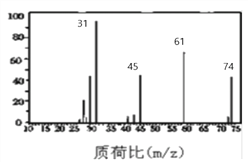
(3)下图是B的质谱图,则其相对分子质量为 ________ ,
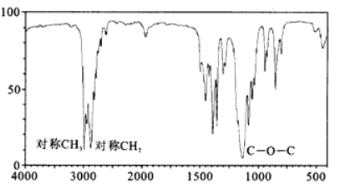
(4)B的红外光谱如图所示,则B的结构简式为__________________________。
(5)准确称取一定质量的A和B的混合物,在足量氧气充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增加14.4g和26.4g。计算混合物中A和B的物质的量之比_____________________。
【答案】A C2H6O CH3CH2OH 74 CH3CH2-O-CH2CH3 1:1
【解析】
根据提示信息了解未知化合物的物理性质从而推断混合物的分离和提纯方法;根据各种谱图推断有机化合物的结构和性质;根据质量守恒原理计算分析解答。
(1)由表格中的信息可知,A. B两种有机物互溶,但沸点不同,则选择蒸馏法分离,故A正确;
故答案为:A;
(2)根据质量守恒定律可知,化合物中所含C元素质量为:8.8g×![]() =2.4g,所含H元素质量为:5.4g×
=2.4g,所含H元素质量为:5.4g×![]() =0.6g,二氧化碳和水中的氧元素质量之和为(8.8g2.4g)+(5.4g0.6g)=11.2g,而氧气的质量为
=0.6g,二氧化碳和水中的氧元素质量之和为(8.8g2.4g)+(5.4g0.6g)=11.2g,而氧气的质量为![]() ×32g/mol=9.6g,所以有机物中氧元素质量为11.2g9.6g=1.6g,n(C):n(H):n(O)=
×32g/mol=9.6g,所以有机物中氧元素质量为11.2g9.6g=1.6g,n(C):n(H):n(O)= ![]() :
:![]() :
:![]() =2:6:1,所以化合物的最简式是C2H6O,在最简式C2H6O中,C、H原子已经达到饱和,其实验式即为分子式,即分子式为C2H6O,该化合物可能为乙醇,也可能为二甲醚,而核磁共振氢谱表明其分子中有三种化学环境不同的氢原子,强度之比为3:2:1,则该化合物为乙醇,结构简式为CH3CH2OH;
=2:6:1,所以化合物的最简式是C2H6O,在最简式C2H6O中,C、H原子已经达到饱和,其实验式即为分子式,即分子式为C2H6O,该化合物可能为乙醇,也可能为二甲醚,而核磁共振氢谱表明其分子中有三种化学环境不同的氢原子,强度之比为3:2:1,则该化合物为乙醇,结构简式为CH3CH2OH;
故答案为:C2H6O,CH3CH2OH;
(3)由物质B的质谱图可知,B的相对分子质量为74,
故答案为:74;
(4)由物质B的红外光谱可知,物质B存在对称的甲基、对称的亚甲基和醚键可得分子的结构简式为:CH3CH2OCH2CH3,
故答案为:CH3CH2OCH2CH3;
(5)将燃烧产物依次通过足量的无水氯化钙和碱石灰,增加的14.4g即水的质量,增加的26.4g即二氧化碳的质量,可得到:n(H2O)= ![]() =0.8mol,n(CO2)=
=0.8mol,n(CO2)= ![]() =0.6mol,设CH3CH2OH、CH3CH2OCH2CH3的物质的量为x、y,则根据C原子和H原子守恒可得2x+4y=0.6;6x+10y=0.8×2;解得:x=0.1mol,y=0.1mol,则A和B的物质的量之比1:1;
=0.6mol,设CH3CH2OH、CH3CH2OCH2CH3的物质的量为x、y,则根据C原子和H原子守恒可得2x+4y=0.6;6x+10y=0.8×2;解得:x=0.1mol,y=0.1mol,则A和B的物质的量之比1:1;
故答案为:1:1。