题目内容
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
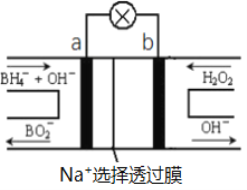
A. 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B. 放电时,每转移1mol电子,理论上有1molNa+透过选择透过膜
C. 电池放电时Na+从b极区移向a极区
D. 电极a发生还原反应
【答案】B
【解析】
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,a为负极,b为正极。结合原电池的工作原理和解答该题
A. 电解质溶液呈碱性,负极发生氧化反应生成BO2,电极反应式为BH4+8OH8e
=BO2+6H2O,故A错误;
B. 原电池中为钠离子选择透过性膜,只允许钠离子通过,每转移1mol电子,理论上有1molNa+透过选择透过膜,故B正确;
C. 原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,故C错误;
D. 根据分析,a 为负极,发生氧化反应,故D错误;
答案选B。

 金博士一点全通系列答案
金博士一点全通系列答案【题目】A和B两种有机物可以互溶,有关性质如下:
物质 | 密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
A | 0.7893 | -117.3 | 78.5 | 与水以任意比混溶 |
B | 0.7137 | -116.6 | 34.5 | 不溶于水 |
(1)要除去A和B的混合物中的少量B,可采用的_______________方法可得到A。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
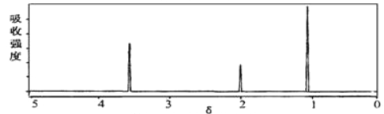
(2)将有机物A置于氧气流中充分燃烧,A和氧气恰好完全反应且消耗6.72L(标准状况)氧气,生成5.4gH2O和8.8gCO2,则该物质的实验式是__________;质谱图显示,A的相对分子质量为46,又已知有机物A的核磁共振氢谱如图所示,则A的结构简式为________________。
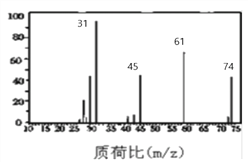
(3)下图是B的质谱图,则其相对分子质量为 ________ ,
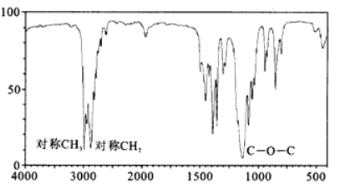
(4)B的红外光谱如图所示,则B的结构简式为__________________________。
(5)准确称取一定质量的A和B的混合物,在足量氧气充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增加14.4g和26.4g。计算混合物中A和B的物质的量之比_____________________。
【题目】硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)![]() 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度 | 450 | 500 | 550 | 600 |
SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
(1)由表中数据判断△H________0(填“>”、“=”或“<”)。
(2)能判断该反应是否达到平衡状态的是___________。
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO3的浓度不变 D. C(SO2)=C(SO3)
E.V正(SO2)=V正(SO3) F. V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1。
①0-2min之间,O2的反应速率为____。
②此时的温度为____℃。
③此温度下的平衡常数为_____(可用分数表示)。
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将_________向移动。