题目内容
10.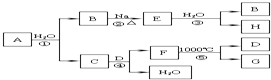 某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )
某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )| A. | 反应①、③中H2O均是还原剂 | |
| B. | D与H溶液反应后所得溶液的溶质成分有三种可能 | |
| C. | 工业上常用C的悬浊液与Cl2反应制取漂白粉 | |
| D. | 电解F与盐酸反应后的溶液以制取单质A |
分析 在自然界存在最广泛的ⅡA族元素中常温下与水反应的是单质Ca,与水反应生成Ca(OH)2和H2,则B是H2,C是Ca(OH)2,E是NaH,H是NaOH,CaCO3受热分解生成CO2和CaO,而CO2恰好与Ca(OH)2反应生成CaCO3和H2O,所以D和G分别是CO2和CaO,以此解答该题.
解答 解:在自然界存在最广泛的ⅡA族元素中常温下与水反应的是单质Ca,与水反应生成Ca(OH)2和H2,则B是H2,C是Ca(OH)2,E是NaH,H是NaOH,CaCO3受热分解生成CO2和CaO,而CO2恰好与Ca(OH)2反应生成CaCO3和H2O,所以D和G分别是CO2和CaO,
A.反应①为Ca+2H2O═Ca(OH)2+H2↑,H2O是氧化剂,反应③为NaH+H2O═NaOH+H2↑,H2O是氧化剂,故A错误;
B.CO2对应的碳酸是二元酸,与NaOH反应时可能会生成两种碳酸盐:Na2CO3和NaHCO3,所得溶液的溶质成分有二种可能,故B错误;
C.C是Ca(OH)2,工业常用Ca(OH)2的悬浊液与Cl2反应制取漂白粉,故C正确;
D.Ca作为活泼的金属元素一般只能通过电解法来制备,可用电解熔融的CaCl2的方法制备,但不能用氯化钙溶液制备,因钙为活泼金属,可与水反应,故D错误.
故选C.
点评 本题主要考查常见金属单质及其化合物之间的相互转化,注意框图推断题的突破口,熟悉元素化合物的性质,题目难度中等.

练习册系列答案
相关题目
20.下列各项中,( )是决定化学反应速率的最主要因素.
| A. | 反应物化学性质 | B. | 温度 | C. | 反应物浓度 | D. | 催化剂 |
1.25℃时,甲溶液的pH是10,乙溶液的pH是11,甲溶液与乙溶液中c(H+)之比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:10 | D. | 10:1 |
18.下列事实不能用勒夏特列原理解释的是( )
| A. | 配制氯化铁溶液时,加入少量稀盐酸 | |
| B. | 配制氯化亚铁溶液时,加入少量铁屑 | |
| C. | 在含有酚酞的氨水中加入少量NH4Cl,溶液颜色会变浅 | |
| D. | 在硫酸铜饱和溶液中加入一块胆矾,晶体外形变规则 |
5.下列化学反应的离子方程式不正确的是( )
| A. | Na2S溶液中加入少量FeCl3溶液:2Fe3++S2-→2Fe2++S↓ | |
| B. | 向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3-→CaCO3↓+2H2O+CO32- | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O→SO42-+Cl-+2H+ | |
| D. | Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: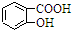 +CO32-→ +CO32-→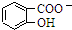 +HCO3- +HCO3- |
2.已知反应A(g)+B(g)?2C(g),B为有色气体,反应平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{[C]^{2}}{[A]•[B]}$,△H<0(填“<”、“>”、“=”).
(2)900℃时,向一个2L的密闭容器中充入2mol的A和8mol的B,如反应初始5s内A的平均反应速率ν(A)=0.1mol•L-1•s-1,则5s时c(C)=1mol•L-1 mol•L-1;若反应经一段时间后反应达到平衡,平衡时B的转化率为20%.
(3)一定温度下,若该反应在体积不变的密闭容器中发生,判断该反应是否达到平衡的依据为bc.
a.气体压强不随时间改变 b.单位时间里生成C和消耗C的量相等
c.气体颜色不随时间改变 d.气体平均摩尔质量不随时间改变
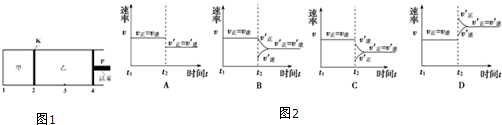
(4)在600℃下将1mol A和1molB加入如图1所示甲容器中,将4molC加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).保持温度和乙中压强不变,t2时刻向乙中再加入2mol He,达到新平衡后,则c(B)甲> c(B)乙(填“>”、“<”或“=”).图象2中能表示乙中反应速率变化情况的是A.
| 温度T (℃) | 600 | 800 | 900 | 1000 | 1200 |
| 平衡常数 K | 7.2 | 4.8 | 4.0 | 2.4 | 0.16 |
(1)该反应的平衡常数表达式K=$\frac{[C]^{2}}{[A]•[B]}$,△H<0(填“<”、“>”、“=”).
(2)900℃时,向一个2L的密闭容器中充入2mol的A和8mol的B,如反应初始5s内A的平均反应速率ν(A)=0.1mol•L-1•s-1,则5s时c(C)=1mol•L-1 mol•L-1;若反应经一段时间后反应达到平衡,平衡时B的转化率为20%.
(3)一定温度下,若该反应在体积不变的密闭容器中发生,判断该反应是否达到平衡的依据为bc.
a.气体压强不随时间改变 b.单位时间里生成C和消耗C的量相等
c.气体颜色不随时间改变 d.气体平均摩尔质量不随时间改变
(4)在600℃下将1mol A和1molB加入如图1所示甲容器中,将4molC加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).保持温度和乙中压强不变,t2时刻向乙中再加入2mol He,达到新平衡后,则c(B)甲> c(B)乙(填“>”、“<”或“=”).图象2中能表示乙中反应速率变化情况的是A.

10.软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4•H2O的流程如下:

已知:①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低.
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为MnO2+SO2=SO42-+Mn2+;
(2)调pH至5-6的目的是沉淀Fe3+和Al3+,调pH至5-6所加的试剂可选择bc(填以下试剂的序号字母);
a.NaOH b.MgO c.CaO d.氨水
(3)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式MnF2+Mg2+=Mn2++MgF2,该反应的平衡常数数值为7.2×107.
(已知:MnF2的KSP=5.3×10-3; CaF2的KSP=1.5×10-10;MgF2的KSP=7.4×10-11)
(4)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是Mn2++H2O=Mn(OH)2+2H+(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为c(SO42-)>c(Mn2+)>c(H+)>c(OH-).

已知:①部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为MnO2+SO2=SO42-+Mn2+;
(2)调pH至5-6的目的是沉淀Fe3+和Al3+,调pH至5-6所加的试剂可选择bc(填以下试剂的序号字母);
a.NaOH b.MgO c.CaO d.氨水
(3)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式MnF2+Mg2+=Mn2++MgF2,该反应的平衡常数数值为7.2×107.
(已知:MnF2的KSP=5.3×10-3; CaF2的KSP=1.5×10-10;MgF2的KSP=7.4×10-11)
(4)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是Mn2++H2O=Mn(OH)2+2H+(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为c(SO42-)>c(Mn2+)>c(H+)>c(OH-).
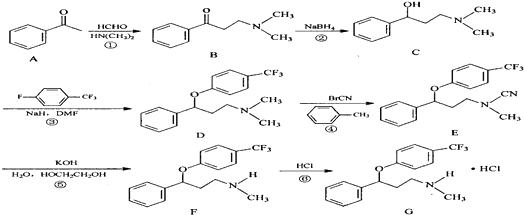

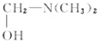 .
.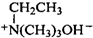 $\stackrel{△}{→}$CH2=CH2;请写出以
$\stackrel{△}{→}$CH2=CH2;请写出以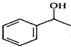 、HCHO、HN(CH3)2为有机原料,合成
、HCHO、HN(CH3)2为有机原料,合成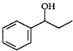 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.