题目内容
18.下列事实不能用勒夏特列原理解释的是( )| A. | 配制氯化铁溶液时,加入少量稀盐酸 | |
| B. | 配制氯化亚铁溶液时,加入少量铁屑 | |
| C. | 在含有酚酞的氨水中加入少量NH4Cl,溶液颜色会变浅 | |
| D. | 在硫酸铜饱和溶液中加入一块胆矾,晶体外形变规则 |
分析 勒沙特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用勒沙特列原理解释.
解答 解:A.氯化铁是强酸弱碱盐,铁离子水解生成氢氧化铁和稀盐酸,所以加入稀盐酸抑制氯化铁水解,则可以用平衡移动原理解释,故A不选;
B.氯化亚铁易被氧化生成铁离子,铁离子和铁反应生成亚铁离子,与平衡移动原理无关,所以不能用平衡移动原理解释,故B选;
C.一水合氨在水溶液中存在电离平衡生成铵根离子和氢氧根离子,加入氯化铵,铵根离子浓度增大,抑制一水合氨电离,溶液碱性减弱而导致颜色变浅,可以用平衡移动原理解释,故C不选;
D.在硫酸铜饱和溶液中存在溶解平衡,硫酸铜溶解的速率等于析出速率,加入一块胆矾时,晶体的质量不变但形状改变,所以可以用平衡移动原理解释,故D不选;
故选B.
点评 本题考查化学平衡移动原理,为高频考点,注意平衡移动原理适用范围及适用条件,如果改变条件时不影响平衡移动,则不能用平衡移动原理解释,为易错点.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
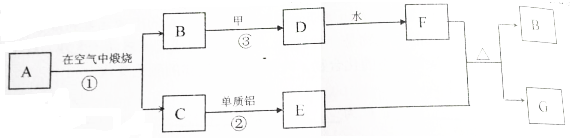
8.设计一个原电池来实现反应:2Fe3++Cu═2Fe2++Cu2+,下列各选项中,电极和电解质溶液选择均正确的是( )
| 选项 | 负极材料 | 正极材料 | 电解质溶液 |
| A | Fe | Cu | Fe(NO3)2 |
| B | Cu | Pt | FeCl2 |
| C | Fe | 石墨 | Fe2(SO4)3 |
| D | Cu | 石墨 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
9.已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
6.对于淀粉和纤维素两物质,下列说法不正确的是( )
| A. | 都可用(C6H10O5)n表示,淀粉有甜味,而纤维素没有 | |
| B. | 二者含C、H、O三种元素的质量分数相同,但不是同分异构体 | |
| C. | 它们都属于糖类,且都是高分子化合物 | |
| D. | 两者在工业上都可以用作生产葡萄糖的原料 |
13.化学与科技、社会、环境密切相关,下列说法不符合科学原理的是( )
| A. | 高纯硅制作光导纤维 | B. | 石墨制作火箭发动机喷管 | ||
| C. | 地沟油水解制取肥皂 | D. | 有机垃圾发酵生产沼气 |
3.根据右表提供的数据可知能大量共存的微粒组是( )
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ki=1.7×10-5 |
| HClO | Ki=3.0×10-8 |
| H2CO3 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | H2CO3、HCO3-、CH3COO-、ClO- | B. | HClO、HCO3-、CH3COO-、ClO- | ||
| C. | HClO、HCO3-、ClO-、CO32- | D. | HCO3-、CH3COO-、ClO-、CO32- |
10.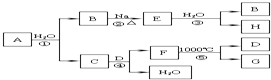 某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )
某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )
 某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )
某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )| A. | 反应①、③中H2O均是还原剂 | |
| B. | D与H溶液反应后所得溶液的溶质成分有三种可能 | |
| C. | 工业上常用C的悬浊液与Cl2反应制取漂白粉 | |
| D. | 电解F与盐酸反应后的溶液以制取单质A |
7.某溶液中含HCO3-,SO32-,CO32-,CH3COO-四种阴离子,向其中加入足量的Na2O2固体后,上列四种阴离子的浓度变化最小的是( )
| A. | HCO3- | B. | SO32- | C. | CO32- | D. | CH3COO- |