题目内容
7.某烷烃M的蒸气密度是相同状况下氢气密度的64倍,经测定得知M中含有6个甲基.M可由烯烃N与H2按物质的量之比1:1加成得到,则烯烃N的结构可能有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 根据气体的密度之比等于摩尔质量之比确定烷烃M的摩尔质量;根据烷烃的通式求出分子式,然后根据要求书写N的结构简式,最后判断即可.
解答 解:因气体的密度之比等于摩尔质量之比,烷烃A蒸气的摩尔质量为2g/mol×64=128g/mol,则12n+2n+2=128,解得n=9,所以烷烃A的分子式为C9H20,若M是烯烃的加成产物,说明N中的C能形成C=C且有6个CH3,因此M可能是(CH3)3CCH2C(CH3)3,此结构不能形成烯烃;
M可能是:(CH3)3CC(CH3)2CH2CH3,此时有1种N;
M可能是:(CH3)3CCH(CH3)CH(CH3)2,N的结构有2种,故N总共有3种,
故答案为:A.
点评 本题主要考查了有机物分子结构的确定方法,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.25℃时,关于①O.l mol.L-1的NH4Cl溶液②0.1mol.L-1的NaOH溶液,下列叙述正确的是( )
| A. | 若向①中加适量水,溶液中$\frac{c(C{l}^{-})}{c(N{H}_{4}^{+})}$的值减小 | |
| B. | 若向②中加适量水,水的电离平衡正向移动 | |
| C. | 若将①和②均稀释100倍,①的pH变化更大 | |
| D. | 若将①和②混合,所得溶液的pH=7,则溶液中的c(NH3.H2O)>c(Na+) |
18.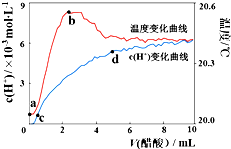 室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
 室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a~b段,醋酸电离过程为放热过程 | |
| B. | c~d段,c(H+)增加,醋酸电离度增加 | |
| C. | c点时,加入等体积等浓度的NaOH溶液则:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | d点时,c(H+)>c(CH3COOH) |
15. 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
(1)铝离子的结构示意图为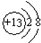 .
.
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)氢氧化铝是医用的胃酸中和剂的一种.用离子方程式表示其作用机理是Al(OH)3+3H+=Al3++3H2O.
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是B (填字母序号).
(6)钢铁的析氢腐蚀简单示意图如图所示,正极的电极反应式为2H++2e-=H2↑.该图某处稍作修改即可成为钢铁电化学防护的简单示意图,其中一种方法是将C换成Zn等比Fe活泼的金属,请完善另一种方法的示意图.
 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:(1)铝离子的结构示意图为
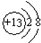 .
.(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)氢氧化铝是医用的胃酸中和剂的一种.用离子方程式表示其作用机理是Al(OH)3+3H+=Al3++3H2O.
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是B (填字母序号).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | Ⅰ对;Ⅱ对. |
| C | 铁比铝更易锈蚀 | 铝比铁活泼 | Ⅰ错;Ⅱ对. |
| D | 铝在空气中表面生成致密氧化膜 | 可用铝罐储存运输浓硫酸、浓硝酸 | Ⅰ错;Ⅱ对. |
2.下列说法正确的是( )
| A. | 取用金属钠时,多余的钠应放置于废液槽中,不应放回原试剂瓶中 | |
| B. | 用足量的稀硫酸可以除去Cu粉中混有的Fe2O3杂质 | |
| C. | 在托盘天平上称取2.0g氢氧化钠固体,然后在100mL容量瓶内溶解并稀释至刻度线,得到0.50mol•L-1氢氧化钠溶液 | |
| D. | 萃取过程中的振摇操作时,需将漏斗上口向下倾斜,下部支管口斜向上方 |
12.某直链一元醇14g能与金属钠完全反应,生成0.2克H2,则此醇的同分异构体数目为( )
| A. | 6个 | B. | 7个 | C. | 8个 | D. | 9个 |
19.对于化学反应A(g)+3B(g)?3C(g),下列措施既可加快反应速度,有可提高A的转化率的是( )
| A. | 使用催化剂 | B. | 增大A物质的浓度 | C. | 增大B物质的浓度 | D. | 减少C物质的浓度 |
17.向AgCl浊液中滴加氨水后可得澄清溶液,继续滴加浓硝酸又有沉淀生成,经查资料得知:Ag++2NH3•H2O?[Ag(NH3)2]++2H2O,下列分析不正确的是( )
| A. | 实验表面实验室可用氨水洗涤银镜反应后的试管 | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| D. | 由资料信息科推知:加浓硝酸后生成的沉淀为AgCl |
18.甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1 mol•L-1甲酸溶液的pH约为2 | |
| B. | 甲酸能与水以任意比例互溶 | |
| C. | 10 mL 1 mol•L-1甲酸恰好与10 mL 1 mol•L-1 NaOH溶液完全反应 | |
| D. | 甲酸溶液的导电性比强酸溶液弱 |