题目内容
15. 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:(1)铝离子的结构示意图为
 .
.(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)氢氧化铝是医用的胃酸中和剂的一种.用离子方程式表示其作用机理是Al(OH)3+3H+=Al3++3H2O.
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是B (填字母序号).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | Ⅰ对;Ⅱ对. |
| C | 铁比铝更易锈蚀 | 铝比铁活泼 | Ⅰ错;Ⅱ对. |
| D | 铝在空气中表面生成致密氧化膜 | 可用铝罐储存运输浓硫酸、浓硝酸 | Ⅰ错;Ⅱ对. |
分析 (1)根据铝离子核内有13个质子,核外有10个电子,据此书写该离子的结构示意图;
(2)FeCl3溶液与铜反应生成氯化亚铁和氯化铜,据此书写反应的离子方程式;
(3)氢氧化具有弱碱性可以中和胃酸,与盐酸反应生成氯化铝和水;
(4)硫酸铁可用作絮凝剂的原理为三价铁离子水解生成氢氧化铁的胶体具有吸附性,但在酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体;
(5)A.地壳中含量最高的金属元素是铝,人类最早使用的金属材料是铜;
B.常温下铁与稀硫酸反应生成氢气,高温下氢气能还原氧化铁得到铁;
C.在金属活动性顺序表中,铝排在铁的前面,比铁活泼,但由于铝表面在空气中表面生成致密氧化膜,所以铁比铝更易锈蚀;
D.铝在空气中表面生成致密氧化膜,铝遇浓硫酸、浓硝酸发生钝化,据此判断;
(6)钢铁的析氢腐蚀,正极氢离子得到电子发生还原反应生成氢气;要防止铁的腐蚀,可以将碳换成锌,形成原电池,采取牺牲阳极的阴极保护法,也可以采用外接电源的阴极保护法.
解答 解:(1)因为铝离子核内有13个质子,核外有10个电子,所以铝离子的结构示意图为 ;故答案为:
;故答案为: ;
;
(2)FeCl3溶液与铜反应生成氯化亚铁和氯化铜,则反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+;故答案为:2Fe3++Cu=2Fe2++Cu2+;
(3)氢氧化具有弱碱性可以中和胃酸,与盐酸反应生成氯化铝和水,离子方程式为:Al(OH)3+3H+=Al3++3H2O;故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)硫酸铁可用作絮凝剂的原理为三价铁离子水解生成氢氧化铁的胶体具有吸附性,但在酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体;故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体;
(5)A.地壳中含量最多的前五种元素:氧、硅、铝、铁、钙,所以地壳中含量最多的金属元素是铝,Ⅰ错误;由于铜的活动性比较弱,以单质形式存在的比较多,所以是人类最早使用的金属材料,Ⅱ错,故A错误;
B.铁的金属活动性比氢强,铁与稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4═FeSO4+H2↑Ⅰ对,氢气与氧化铁在高温条件下反应生成铁和水.该反应的化学方程式为:3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2OⅡ对,故B正确;
C.在金属活动性顺序表中,铝排在铁的前面,比铁活泼,则Ⅱ对,但由于铝表面在空气中表面生成致密氧化膜,所以铁比铝更易锈蚀,则Ⅰ对,故C错误;
D.铝在空气中表面生成致密氧化膜则Ⅰ对,因为铝遇浓硫酸、浓硝酸发生钝化,所以可以用铝罐储存运输浓硫酸、浓硝酸,则Ⅱ对,故D错误;
故选B;
(6)钢铁的析氢腐蚀,正极氢离子得到电子发生还原反应生成氢气,电极反应式为:2H ++2e-=H2↑;要防止铁的腐蚀,可以将碳换成锌,形成原电池,采取牺牲阳极的阴极保护法,也可以采用外接电源的阴极保护法,所以应将铁与负极相连作阴极,图为: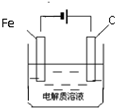 ;
;
故答案为:2H ++2e-=H2↑; .
.
点评 本题考查较为综合,涉及金属的性质的综合应用,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | 1mol苯中含有3nA个碳碳双键 | |
| B. | 标准状况下,22.4 L乙烯和丙烯混合气体中所含的分子数目为2nA | |
| C. | 1mol Cl2与足量Fe粉反应生成FeCl3,转移2nA个电子 | |
| D. | 1L 0.1 mol•L-1 Na2S溶液中含有0.1nA个S2- |
| A. | 正、逆反应速率都减小,平衡不移动 | |
| B. | 正、逆反应速率都减小,平衡向正反应方向移动 | |
| C. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| A. | 常温常压下,17g氨气分子所含质子数为10NA | |
| B. | 1mol CL2参加反应,转移电子数一定为2N | |
| C. | 常温常压下,22.4 L C02分子中含有2NA个σ键和2NA个1π键 | |
| D. | 1 L 0.01 mol.L-1的Na2CO3溶液中含有0.01NA个CO2- |
| A. | PH3 | B. | NH3 | C. | H2O | D. | CH4 |
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率ν(Z)=2.0×10-5 mol/(L•min) | |
| B. | 4min时,ν(逆)>ν(正) | |
| C. | 该温度下,此反应的平衡常数K=1.44 | |
| D. | 7min时,反应还未达到平衡状态 |
| A. | 浓苯酚溶液中滴加少量稀溴水 | B. | NaAlO2溶液滴入过量苯酚溶液 | ||
| C. | 稀苯酚钠溶液中通入少量CO2 | D. | AgNO3溶液中滴入过量氨水 |