题目内容
17.25℃时,关于①O.l mol.L-1的NH4Cl溶液②0.1mol.L-1的NaOH溶液,下列叙述正确的是( )| A. | 若向①中加适量水,溶液中$\frac{c(C{l}^{-})}{c(N{H}_{4}^{+})}$的值减小 | |
| B. | 若向②中加适量水,水的电离平衡正向移动 | |
| C. | 若将①和②均稀释100倍,①的pH变化更大 | |
| D. | 若将①和②混合,所得溶液的pH=7,则溶液中的c(NH3.H2O)>c(Na+) |
分析 A、加水稀释促进水解铵根离子物质的量减小,氯离子物质的量不变;
B、酸碱抑制水的电离,加水稀释氢氧化钠溶液,氢氧根离子浓度减小,水的电离程度增大;
C、加水稀释促进铵根离子水解,氯化铵溶液中氢离子浓度减小小于100倍,氢氧化钠溶液氢氧根离子浓度减小100倍;
D、①O.l mol.L-1的NH4Cl溶液②0.1mol.L-1的NaOH溶液,等体积混合,生成一水合氨和氯化钠,溶液显碱性,若使溶液呈中性,需要氯化铵溶液体积大于氢氧化钠溶液,结合溶液中电荷守恒说明.
解答 解:A、加水稀释促进水解铵根离子物质的量减小,氯离子物质的量不变,同一溶液中体积相同,浓度关系是物质的量关系,所以比值增大,故A错误;
B、酸碱抑制水的电离,加水稀释氢氧化钠溶液,氢氧根离子浓度减小,抑制程度减小,水的电离程度增大,故B正确;
C、加水稀释促进铵根离子水解,氯化铵溶液中氢离子浓度减小小于100倍,氢氧化钠溶液氢氧根离子浓度减小100倍,②的pH变化更大,故C错误;
D、①O.l mol.L-1的NH4Cl溶液②0.1mol.L-1的NaOH溶液,等体积混合,生成一水合氨和氯化钠溶液显碱性,若使溶液呈中性,需要氯化铵溶液体积大于氢氧化钠溶液,溶液中溶质为氯化铵和一水合氨,溶液中电荷守恒c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(Cl-),pH=7得到c(Na+)+c(NH4+)=c(Cl-),结合物料守恒c(NH3.H2O)+c(NH4+)=c(Cl-),溶液中的c(NH3.H2O)=c(Na+),故D错误;
故选B.
点评 本题考查了盐类水解平衡的影响因素分析,溶液稀释对水电离的影响因素判断,溶液中电荷守恒的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
8.设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 常温常压下,2.8gN2与C2H4的混合气体中含有的电子数为1.4NA | |
| B. | 标准状况下,1.12L NO与1.12LO2的混合物中含有的原子数为0.2NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氧原子数为0.3NA |
5.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol苯中含有3nA个碳碳双键 | |
| B. | 标准状况下,22.4 L乙烯和丙烯混合气体中所含的分子数目为2nA | |
| C. | 1mol Cl2与足量Fe粉反应生成FeCl3,转移2nA个电子 | |
| D. | 1L 0.1 mol•L-1 Na2S溶液中含有0.1nA个S2- |
12.下列实验不能达到目的是( )
| A. | 用分液的方法分离乙醇和乙酸 | |
| B. | 用NaOH溶液除去溴苯中的溴 | |
| C. | 用NaAlO2溶液和过量盐酸制备Al(OH)3 | |
| D. | 用足量铁粉除去FeCl2溶液中的FeCl3杂质 |
2.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH同时得到某种副产物,其原理如图所示(电极材料为石墨).下列说法不正确的是( )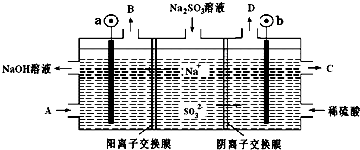

| A. | b电极上的主反应是 SO32--2e-+H2O═SO42-+2H+ | |
| B. | 若D是混合气体,则可能含有SO2、O2等成分 | |
| C. | a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体 | |
| D. | A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液 |
9.下列说法正确的是( )
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,证明该反应的△H<0 | |
| B. | 常温下,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同 | |
| C. | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) | |
| D. | 等体积、等物质的量浓度的NH3•H2O溶液与NH4Cl溶液混合后溶液呈碱性,说明NH3•H2O的电离程度小于NH${\;}_{4}^{+}$的水解程度 |
6.在固定容积的密闭容器中,可逆反应2X(g)+2Y(s)?3Z(g),达到平衡后,若将容器中X、Y、Z的物质的量均减少一半,对该反应产生的影响是( )
| A. | 正、逆反应速率都减小,平衡不移动 | |
| B. | 正、逆反应速率都减小,平衡向正反应方向移动 | |
| C. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
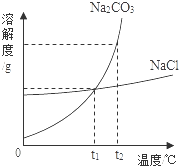 我国化学家侯德榜创立的侯氏制碱法,就是以海水晒盐得到的氯化钠为原料,制得纯碱碳酸钠,碳酸钠和氯化钠的溶解度曲线如图所示,试回答下列问题:
我国化学家侯德榜创立的侯氏制碱法,就是以海水晒盐得到的氯化钠为原料,制得纯碱碳酸钠,碳酸钠和氯化钠的溶解度曲线如图所示,试回答下列问题: