题目内容
18.甲酸的下列性质中,可以证明它是弱电解质的是( )| A. | 1 mol•L-1甲酸溶液的pH约为2 | |
| B. | 甲酸能与水以任意比例互溶 | |
| C. | 10 mL 1 mol•L-1甲酸恰好与10 mL 1 mol•L-1 NaOH溶液完全反应 | |
| D. | 甲酸溶液的导电性比强酸溶液弱 |
分析 A.甲酸是弱电解质,不能完全电离;
B.甲酸与水以任意比例互溶,这是甲酸的物理性质,不能证明是弱电解质;
C.是中和反应,按照反应方程式进行;
D.溶液的导电性取决于自由移动离子浓度和自由移动离子带电数目.
解答 解:A.1mol•L-1的甲酸溶液的c(H+)约为0.01mol•L-1说明甲酸不能完全电离,可以证明是弱电解质,故A正确;
B.甲酸水溶性是物理性质,不能证明是弱电解质,故B错误;
C.根据方程式可知不论酸碱强弱,只有一元酸与一元碱物质的量相等则恰好发生酸碱中和,完全反应,故C错误;
D.缺少条件,溶液浓度不确定,甲酸溶液的导电性比盐酸溶液可能强也可能弱,故D错误;
故选A.
点评 本题考查了弱电解质的判断,题目难度不大,注意把握住弱电解质的定义“部分电离”的特点.

练习册系列答案
相关题目
9.某元素R的最高价氧化物的化学式为RO2,其气态氢化物中氢的质量分数为25%,此元素是( )
| A. | C | B. | N | C. | Si | D. | S |
6.下列实验完毕后,一定能出现白色浑浊现象的是( )
| A. | 浓苯酚溶液中滴加少量稀溴水 | B. | NaAlO2溶液滴入过量苯酚溶液 | ||
| C. | 稀苯酚钠溶液中通入少量CO2 | D. | AgNO3溶液中滴入过量氨水 |
13.下列离子方程式正确的是( )
| A. | 用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=NO${\;}_{3}^{-}$+NO↑+H2O | |
| B. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ | |
| C. | 氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O | |
| D. | NH4HSO4溶液中加入等物质的量的Ba(OH)2溶液:NH4++H++SO42一+Ba2++2OH?=NH3•H2O+BaSO4↓+H2O |
3.下列各组粒子,核外电子总数和质子总数均相同的是( )
| A. | S2-和HS- | B. | H3O+和OH- | C. | Na+和NH${\;}_{4}^{+}$ | D. | K+和Ne |
10.从下列反应物到生成物,反应类型可能属于消去反应的是( )
| A. | 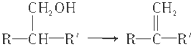 | B. | 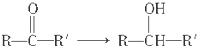 | ||
| C. | R-X→ROH | D. | 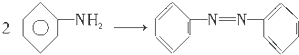 |
7.下列说法或表示方法正确的是( )
| A. | 2A(l)+B(l)=2C(l)△H1 2A (g)+B(g)=2C(l)△H2 则△H1>△H2 | |
| B. | 31g红磷变成31g白磷要吸收能量,说明红磷比白磷更稳定 | |
| C. | 测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH的起始温度和反应结束后稳定的温度 | |
| D. | 在101 kPa时,已知氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol |
8.下列有关化学用语表述不正确的是( )
| A. | 氨气分子的电子式: | B. | CO2分子的结构式:O=C=O | ||
| C. | S2-的结构示意图: | D. | CH4的分子模型示意图为: |