题目内容
2.下列说法正确的是( )| A. | 取用金属钠时,多余的钠应放置于废液槽中,不应放回原试剂瓶中 | |
| B. | 用足量的稀硫酸可以除去Cu粉中混有的Fe2O3杂质 | |
| C. | 在托盘天平上称取2.0g氢氧化钠固体,然后在100mL容量瓶内溶解并稀释至刻度线,得到0.50mol•L-1氢氧化钠溶液 | |
| D. | 萃取过程中的振摇操作时,需将漏斗上口向下倾斜,下部支管口斜向上方 |
分析 A.取用金属钠或钾做完实验后,剩余的药品要放回原瓶;
B.Cu可与硫酸铁反应;
C.容量瓶不能溶解物质;
D.漏斗的上口向下倾斜,下部支管指向斜上方.
解答 解:A.试剂瓶中的钠是块状固体而不是粉末状固体,不像一些粉末状的药物一旦受污染就不易清除,故A错误;
B.Fe2O3与硫酸反应生成硫酸铁,Cu可与硫酸铁反应,故B错误;
C.容量瓶不能溶解物质,应在烧杯中溶解,故C错误;
D.振摇操作时,将漏斗的上口向下倾斜,下部支管指向斜上方(朝向无人处),故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及除杂、溶液配制、萃取等混合物的分离方法,侧重实验操作的考查,题目难度不大.

练习册系列答案
相关题目
12.下列实验不能达到目的是( )
| A. | 用分液的方法分离乙醇和乙酸 | |
| B. | 用NaOH溶液除去溴苯中的溴 | |
| C. | 用NaAlO2溶液和过量盐酸制备Al(OH)3 | |
| D. | 用足量铁粉除去FeCl2溶液中的FeCl3杂质 |
13.已知温度T时KW=1.0×10-12,0.1mol/L Na2A溶液pH=6,则下列说法中,正确的是( )
| A. | 该温度下,0.005mol/L H2A溶液中水电离出的c(H+)=10-12mol/L | |
| B. | H2A在水溶液中的电离方程式为:H2A?H++HA-,HA-?A2-+H+ | |
| C. | (NH4)2A溶液中存在离子浓度关系:(NH4+)>(A2-)>(H+)>(OH-) | |
| D. | 等体积等浓度的盐酸与H2A溶液分别与5.6gFe反应,H2A产生的H2多 |
17.用下列装置进行相应实验,能达到实验目的是( )
| 选项 | A | B | C | D |
| 装置 | 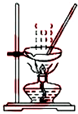 | 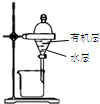 有机层水层 | 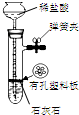 | 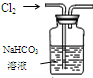 |
| 目的 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 分离CCl4萃取碘水后已分层的有机层和水层 | 制取少量CO2气体 | 除去Cl2中含有的少量HCl |
| A. | A | B. | B | C. | C | D. | D |
14.下列叙述正确的是( )
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
| A. | ① | B. | ①②⑤ | C. | 只有③④ | D. | ①②③④⑤ |
13.下列离子方程式正确的是( )
| A. | 用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=NO${\;}_{3}^{-}$+NO↑+H2O | |
| B. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ | |
| C. | 氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O | |
| D. | NH4HSO4溶液中加入等物质的量的Ba(OH)2溶液:NH4++H++SO42一+Ba2++2OH?=NH3•H2O+BaSO4↓+H2O |