题目内容
17.某一元弱酸HA在水中的电离方程式为:HA?H++A-( i)向该溶液中加入适量NaA固体,上述平衡将向逆(填“正”或“逆”)反应方向移动.
( ii)若向溶液中加入适量NaCl溶液,上述平衡将向正(填“正”或“逆”)反应方向移动,
溶液中的c(A-)将减小(填“增大”、“减小”或“不变”),溶液中的c(OH-)将增大(填“增大”、“减小”或“不变”)
分析 弱酸电离可逆;
(i)向溶液中加入适量NaA固体,c(A-)增大,结合浓度对平衡移动的影响分析;
(ii)若向溶液中加入适量NaCl溶液,NaCl对平衡无影响,但溶液体积增大,促进电离;
解答 解:弱酸电离可逆,电离方程式是:HA?H++A-,故答案为:HA?H++A-;
(i)向溶液中加入适量NaA固体,c(A-)增大,平衡向减小c(A-)的方向即逆反应方向移动,
故答案为:逆;
(ii)若向溶液中加入适量NaCl溶液,NaCl对平衡无影响,但溶液体积增大,促进电离,平衡向正方向移动,溶液中c(A-)减小,c(H+)减小,则c(OH-)增大,
故答案为:正;减小;增大.
点评 本题考查弱电解质的电离平衡及其影响因素,注意掌握影响弱电解质的电离平衡的因素,要求学生在学习中注意相关基础知识的积累,题目难度不大.

练习册系列答案
相关题目
8.下列化学用语正确的是( )
| A. | 三氟化氮的电子式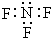 | B. | 水合氢离子电子式: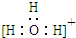 | ||
| C. | 氟离子的结构示意图: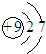 | D. | 中子数为18的硫原子${\;}_{16}^{34}$S |
5.在下列各说法中,正确的是( )
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0表示放热,△H<0表示吸热 | |
| C. | 0.5mol H2SO4与0.5molBa(OH)2反应生成1mol水时放出的热叫做中和热 | |
| D. | 1molH2与0.5molO2燃烧放出的热就是H2的燃烧热 |
12.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH═CH3COO-+H+,要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大,可以采取的措施有( )
①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水.
①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水.
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①④ |
2.Na和Na+两种粒子中,不相同的是( )
①核内质子数 ②核外电子数 ③最外层电子数 ④核外电子层数.
①核内质子数 ②核外电子数 ③最外层电子数 ④核外电子层数.
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ②③④ |
6.下列说法正确的是( )
| A. | 蒸干碳酸钾溶液得到的固体物质为KOH | |
| B. | 铁表面镀铜时,铜与电源的负极相连,而铁与电源的正极相连 | |
| C. | 工业合成氨反应温度选择700 K左右,可使催化剂活性最强并提高原料利用率 | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=2×283.0kJ/mol |
17.下列化合物中阳离子比阴离子多1个电子层的是( )
| A. | NaCl | B. | MgBr2 | C. | CaCl2 | D. | K2O |
