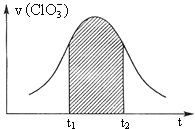
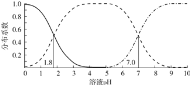
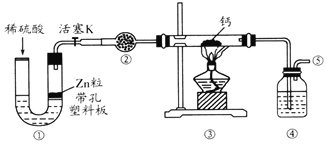
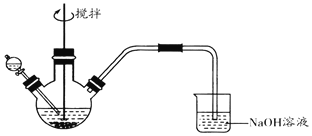
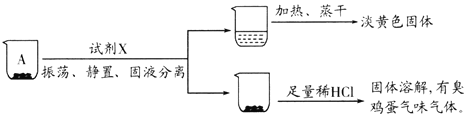
题目内容
【题目】化工生产中用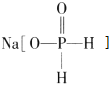 (次磷酸钠)进行化学镀铜,反应的化学方程式为 CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2↑.下列说法正确的是( )
(次磷酸钠)进行化学镀铜,反应的化学方程式为 CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2↑.下列说法正确的是( )
A.化学反应中,还原产物为Cu和H2
B.CuSO4溶液中离子浓度的大小顺序为c(SO42-)>c(Cu2+)>c(OH-)>c(H+)
C.溶液中H2PO2-的电离方程式为H2PO2-H++HPO22-
D.NaH2PO3与过量NaOH反应生成Na2HPO3,判断H3PO3为二元酸
【答案】AD
【解析】
A、反应中,Cu、H元素化合价降低、发生还原反应,P元素化合价升高、发生氧化反应;
B、CuSO4是强酸弱碱盐,水解显酸性,结合电荷关系判断;
C、根据次磷酸钠的物质结构可知,H3PO2是一元酸,H2PO2-不能电离;
D、NaH2PO3与过量NaOH反应生成Na2HPO3,则NaH2PO3为酸式盐、Na2HPO3是正盐。
A、反应CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2↑中,Cu、H元素化合价降低、发生还原反应,所以Cu和H2为还原产物,故A正确;
B、CuSO4是强酸弱碱盐,水解显酸性,即c(H+)>c(OH-),电荷关系为2c(SO42-)+c(OH-)=2c(Cu2+)+c(H+),即c(SO42-)>c(Cu2+),所以CuSO4溶液中离子浓度的大小顺序为c(SO42-)>c(Cu2+)>c(H+)>c(OH-),故B错误;
C、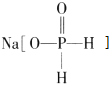 中H2PO2-没有羟基,所以次磷酸钠为正盐,H2PO2-不能电离出H+,但能水解,故C错误;
中H2PO2-没有羟基,所以次磷酸钠为正盐,H2PO2-不能电离出H+,但能水解,故C错误;
D、NaH2PO3与过量NaOH反应生成Na2HPO3,则NaH2PO3为酸式盐、Na2HPO3是正盐,说明H3PO3分子中只有两个羟基,所以H3PO3为二元酸,故D正确;
故选:AD。

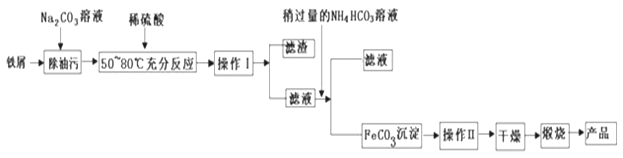
【题目】钼酸钠(Na2MoO4)是一种重要的化工原料。用废加氢催化剂(含有MoS2和Al2O3、Fe2O3、SiO2等)为原料制取钼酸钠,工艺流程如图所示:

已知:MoO3、A12O3在高温下能跟Na2CO3发生反应。
回答下列问题:
(1)Na2MoO4中Mo元素的化合价______。
(2)废加氢催化剂焙烧目的是脱除表面油脂、硫等。请根据表中实验数据分析,废加氢催化剂预处理温度应选择______℃。
废催化剂在不同温度下的烧残(时间:2h)
温度 /℃ | 300 | 350 | 400 | 500 | 600 |
烧前 /g | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 |
烧后 /g | 48.09 | 47.48 | 47.19 | 46.55 | 46.52 |
烧残, % | 96.2 | 95.0 | 94.4 | 93.1 | 93.0 |
(3)焙烧时生成MoO3的化学方程式为______,当生成1mol MoO3转移电子数为______NA。
(4)加碳酸钠碱性焙烧时主要反应的化学方程式为______。
(5)用50t含MoS2为80%的废加氢催化剂,经过制取、分离、提纯,得到30.9t Na2MoO4,则Na2MoO4的产率为______。
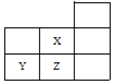
【题目】如图是元素周期表的一部分:
数据编号 | 滴入NaOH溶液的体积 | 溶液的pH | |
HX | HZ | ||
1 | 0 | 3 | 1 |
2 |
| a | b |
![]() 时,用浓度为
时,用浓度为![]() 的氢氧化钠溶液分别滴定
的氢氧化钠溶液分别滴定![]() 浓度均为
浓度均为![]() 的两种酸HX、
的两种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如表2,下列判断正确的是
,实验数据如表2,下列判断正确的是![]()
A.通过分析可得表格中![]() ,
,![]()
B.将上述的HZ溶液稀释100倍后pH比HX溶液的pH大
C.由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强
D.![]()
![]()
![]() 的水溶液中:
的水溶液中:![]()
![]()