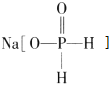
题目内容
【题目】化学小组探究FeCl3溶液与Na2S溶液的反应产物,利用图装置进行如下实验:
Ⅰ.向盛有0.1 molL-1FeCl3溶液的三颈瓶中,滴加一定量0.1 molL-1Na2S溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
Ⅱ.向盛有0.1 molL-1 Na2S溶液的三颈瓶中,滴加少量0.1molL-1 FeCl3溶液,搅拌,产生沉淀B。
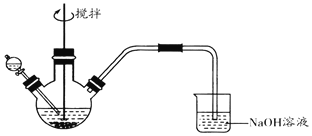
已知:①FeS2为黑色固体,且不溶于水和盐酸。②Ksp(Fe2S3)=1×10-88,Ksp(FeS2)=6.3×10-31,Ksp[Fe(OH)3]=1×10-38,Ksp(FeS)=4×10-19
回答下列问题:
(1)NaOH溶液的作用是______。
小组同学猜测,沉淀A、B可能为S、硫化物或它们的混合物。他们设计如下实验进行探究:
实验一、探究A的成分
取沉淀A于小烧杯中,进行如下实验:
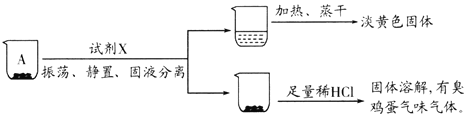
(2)试剂X是______。由此推断A的成分是______(填化学式)。
实验二、探究B的成分
取沉淀B于小烧杯中,进行如下实验:

(3)向试管a中加入试剂Y,观察到明显现象,证明溶液中存在Fe2+.试剂Y是______,明显现象是______。由此推断B的成分是______(填化学式)。
(4)请分析Ⅱ中实验未得到Fe(OH)3的原因是______。
【答案】吸收H2S有毒气体 二硫化碳 FeS和S的混合物 K3[Fe(CN)6]溶液或NaOH溶液 生成蓝色沉淀或生成白色沉淀,转化为灰绿色、最后变为红褐色 Fe2S3 由溶度积数据知,Fe2S3的溶解度远小于Fe(OH)3,Fe3+更容易生成Fe2S3沉淀
【解析】
(1)实验中产生了臭鸡蛋气味的H2S有毒气体,为避免污染环境,用氢氧化钠吸收,
故答案为:吸收H2S有毒气体;
(2)实验现象中分离出淡黄色固体硫,硫的溶解度是:易溶于二硫化碳、微溶于酒精、不溶于水,固体加盐酸后溶解闻到臭鸡蛋气味,说明是FeS,
故答案为:二硫化碳;FeS和S的混合物;
(3)亚铁离子和K3[Fe(CN)6]溶液反应生成蓝色沉淀,亚铁离子遇到NaOH溶液生成白色沉淀,转化为灰绿色、最后变为红褐色;FeCl3溶液和Na2S溶液间可发生复分解反应生成Fe2S3也可发生氧化还原反应生成FeS和S的混合物,根据加试剂X得溶液甲加热无淡黄色固体,说明无硫单质,及后续实验和现象,故FeCl3溶液和Na2S溶液间发生复分解反应生成Fe2S3;
故答案为:K3[Fe(CN)6]溶液或NaOH溶液;生成蓝色沉淀或生成白色沉淀,转化为灰绿色、最后变为红褐色;Fe2S3;
(4)已知Fe(OH)3=10-39,Fe2S3=10-88,可知Fe2S3的溶解度远小于Fe(OH)3,则Fe3+更容易生成Fe2S3沉淀,
故答案为:由溶度积数据知,Fe2S3的溶解度远小于Fe(OH)3,Fe3+更容易生成Fe2S3沉淀。

【题目】某化学兴趣小组对加碘食盐中碘酸钾进行研究,查阅资料得知:碘酸钾是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂与HI、H2O2等物质作用,被还原为单质碘。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
①称取wg加碘盐,加适量蒸馏水溶解。
②用稀硫酸酸化所得的溶液,再加入过量KI溶液,写出该步反应的离子方程式:_______。
③以淀粉为指示剂,用物质的量浓度为1.00×10-3molL-1的Na2S2O3溶液滴定![]() 滴定时的反应方程式为
滴定时的反应方程式为![]() ,滴定时Na2S2O3溶液应放在 ______
,滴定时Na2S2O3溶液应放在 ______ ![]() 填“酸式滴定管”或“碱式滴定管”
填“酸式滴定管”或“碱式滴定管”![]() ,滴定至终点的现象为_______________。
,滴定至终点的现象为_______________。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加适量蒸馏水溶解 | 溶液无变化 |
② | 滴入少量淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 然后再滴加稀硫酸,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因: __________________ ;根据学生乙的实验结果可推测学生甲的实验结果可能 ______ (填“偏大”、“偏小”或“无影响”)。
(3)学生丙设计实验证明加碘食盐样品中碘元素的存在形式是IO3-而不是I-,进行如下实验。写出实验步骤、预期现象和结论。限选试剂:稀硫酸、稀硝酸、3% H2O2溶液、新制氯水、1%淀粉溶液、蒸馏水。
实验步骤 | 预期现象和结论 |
步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, _____________________ | ______ |
步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,滴入适量的稀硫酸酸化, _____________________ | ______ |
【题目】已知:H2(g)+I2(g)![]() 2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
起始浓度 | c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)(mol·L-1) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25