题目内容
【题目】铁及其化合物在生产和生活中有着广泛的应用.
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
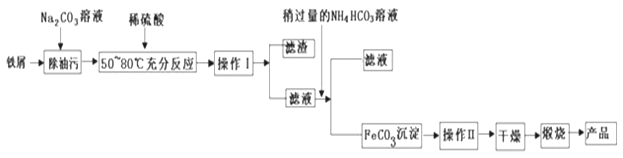
回答下列问题:
(1)操作Ⅰ、II的名称分别是______、_______.写出在空气中煅烧FeCO3生成Fe2O3的化学方程式__________________________。
(2)某同学在实验室中用KMnO4溶液滴定的方法来测定绿矾(FeSO47H2O)样品的纯度,操作过程如下:
a.称取3.00g绿矾(FeSO47H2O)样品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定达到终点时锥形瓶中溶液颜色变化为:__________________且半分钟内不恢复原色
②计算上述样品中FeSO47H2O的质量分数为_______ 已知(M(FeSO47H2O)=278g/mol)
③写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式_________________________
④下列操作会导致样品中FeSO47H2O的质量分数的测定结果偏高的有_________.
a.盛装标准液的滴定管没有用标准液润洗
b.未干燥锥形瓶
c.滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视.
【答案】过滤 洗涤 4FeCO3+O2![]() 2Fe2O3+4CO2 溶液由浅绿色变成紫红色 0.9266 5Fe2++MnO4+8H+=Fe3++2Mn2++4H2O a d
2Fe2O3+4CO2 溶液由浅绿色变成紫红色 0.9266 5Fe2++MnO4+8H+=Fe3++2Mn2++4H2O a d
【解析】
(1)分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤;
(2)①.亚铁离子被氧化为三价铁离子,高锰酸钾溶液做指示剂,滴定终点时溶液由浅绿色变为紫红色,且半分钟内不立即褪去;
②.根据5Fe2+---MnO4-关系,计算出n(![]() ),从而配制的250mL溶液中含亚铁离子物质的量,根据n(Fe2+)=n(FeSO47H2O)关系计算出绿矾的质量,计算出质量分数;
),从而配制的250mL溶液中含亚铁离子物质的量,根据n(Fe2+)=n(FeSO47H2O)关系计算出绿矾的质量,计算出质量分数;
③高锰酸钾具有氧化性,能够把亚铁离子氧化为铁离子,据此写出离子方程式;
④依据滴定过程中c(待测)=c(标准)V(标准)/ V(待测),操作中引起的误差需要分析标准液的体积变化。
(1)分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤,故答案为:过滤;洗涤;在空气中煅烧![]() ,
,![]() 与氧气反应生成三氧化二铁和二氧化碳,故答案为:
与氧气反应生成三氧化二铁和二氧化碳,故答案为:![]() ;
;
(2)①滴定实验是利用高锰酸钾溶液的颜色变化指示反应终点,所以反应完全后,溶液呈紫红色,故答案为:溶液由浅绿色变为紫红色,且半分钟内不立即褪去;
②.依据步骤分析,25mL溶液被高锰酸钾溶液滴定反应,终点时消耗亚铁离子物质的量为:
![]()
1 5
1mol 5mol
故n(![]() )=0.001mol,配制的250mL溶液中含亚铁离子物质的量n=0.01mol;样品中绿矾的质量分数=
)=0.001mol,配制的250mL溶液中含亚铁离子物质的量n=0.01mol;样品中绿矾的质量分数=![]() ×100%=97.5%,故答案为:97.5%;
×100%=97.5%,故答案为:97.5%;
③高锰酸钾具有氧化性,能够把亚铁离子氧化为铁离子,本身被还原为锰离子,离子方程式为:![]() ;
;
④.依据滴定过程中c(待测)=c(标准)V(标准)/ V(待测),操作中引起的误差需要分析标准液的体积变化,a.盛装标准液的滴定管没有用标准液润洗,则导致标准液稀释浓度实际减小V(标准)增大,故结果偏高;b.未干燥锥形瓶,不影响待测液的物质的量的变化,故结果没变化;c.滴定终点时滴定管尖嘴中产生气泡,则V(标准)偏小故结果偏低;d.量取待测液,视线注视刻度时开始平视、结束俯视,俯视滴定管读数偏小,则V(待测)偏小,故测定结果偏高;故选a d;

【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快