题目内容
7.S4N4的结构如图: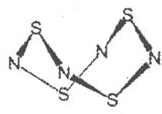
(1)S4N4的晶体类型是分子晶体
(2)用干燥的氨作用于S2Cl2的CCl4溶液中可制S4N4,化学反应方程为:6S2Cl2+16NH3=S4N4+S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是da.离子键b.极性键c.非极性键d.金属键 e.配位键 f.范德华力
②S2Cl2中,S原子轨道的杂化类型是sp3.
分析 (1)根据晶体的构成微粒确定晶体类型,由分子构成的晶体为分子晶体,由原子构成的晶体为原子晶体;
(2)①同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,铵根离子和酸根离子之间存在离子键,含有孤电子对和含有空轨道的原子之间形成配位键;分子晶体中分子之间存在范德华力;
②根据价层电子对互斥理论确定S原子杂化类型.
解答 解:(1)S4N4的晶体是由分子构成的,属于分子晶体,故答案为:分子晶体;
(2)①该反应6S2Cl2+16NH3=S4N4+S8+12NH4Cl的NH3中含有极性键和范德华力、氯化铵中含有配位键、极性键和离子键,S8中含有范德华力和非极性键,S4N4中含有范德华力和极性键,所以没有破坏或形成的微粒间作用力是金属键,故选d;
②S2Cl2中,其结构式为Cl-S-S-Cl,每个S原子含有两个σ键和两个孤电子对,所以每个S原子价层电子对个数是4,则为sp3杂化,故答案为:sp3.
点评 本题考查晶体类型的判断、原子杂化方式判断、化学键和分子间作用力等知识点,为高考高频点,明确晶体构成微粒与晶体类型的关系、价层电子对互斥理论即可解答,注意配位键也属于共价键,氢键属于分子间作用力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列过程不能实现化学能转化为热能的是( )
| A. | 碳酸钙受热分解 | B. | 乙烷燃烧 | ||
| C. | 铝粉与四氧化三铁反应 | D. | 铁与盐酸反应 |
18.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 12g金刚石晶体中含有的C-C的数目为2NA | |
| B. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA | |
| D. | 标准状况下,22gCO2气体中含有的σ键和π键的数目均为2NA |
15.下列表述正确的是( )
| A. | 钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂 | |
| B. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| C. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污渍 | |
| D. | 高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸 |
12.化学反应中,有时存在一种物质过量,另一种物质仍不能完全反应的特殊情况,下列反应中属于这种情况的是( )
①过量的锌与18mol/L硫酸溶液反应
②过量的氢气与少量的氮气在催化剂存在和一定条件下充分反应
③加热条件下浓盐酸与过量MnO2 反应
④加热条件下过量铜与浓硫酸反应
⑤过量稀硫酸与块状石灰石反应.
①过量的锌与18mol/L硫酸溶液反应
②过量的氢气与少量的氮气在催化剂存在和一定条件下充分反应
③加热条件下浓盐酸与过量MnO2 反应
④加热条件下过量铜与浓硫酸反应
⑤过量稀硫酸与块状石灰石反应.
| A. | ②③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②③④⑤ |
19.下列除杂方法不正确的是( )
| A. | 除去MgCl2溶液中的Fe3+,可向溶液中加入氨水调节pH | |
| B. | 除去污水中的金属离子Cu2+、Hg2+,可向溶液中加入FeS | |
| C. | 除去Cl2中混有的HCl,可以将气体通入饱和氯化钠溶液 | |
| D. | 除去CaCO3中的少量CaSO4,可以向其中加入足量饱和Na2CO3溶液后过滤 |

 .
. .
. =O$→_{H+}^{ROH}$
=O$→_{H+}^{ROH}$ $→_{H+}^{ROH}$
$→_{H+}^{ROH}$ 写出由乙烯、甲醇为有机原料制备化合物
写出由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2Br•CH2Br.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2Br•CH2Br.