��Ŀ����
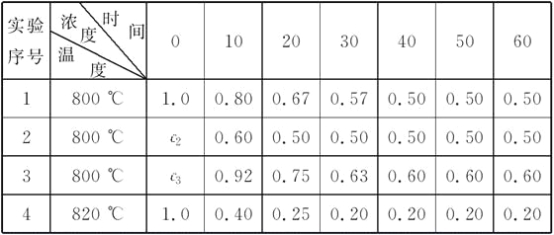
����Ŀ��������ʵ��д�����з�Ӧ���Ȼ�ѧ����ʽ��
��1����25�桢101kPa�£�1g�״���CH3OH��ȼ������CO2��Һ̬ˮʱ����22.68kJ�����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ___��
��2��25�桢101kPa��������N2��O2��ȫ��Ӧ��ÿ����23gNO2��Ҫ����16.95kJ����___��
��3��25�桢101kPa��֪��1mol H��H����1molN��H����1molN��N���ֱ���Ҫ��������436kJ��391kJ��946kJ����N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ___��
��4���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϡ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ��������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO(g)+2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g)![]() CH3OH��g��+H2O(g) ��H2
CH3OH��g��+H2O(g) ��H2
��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H3
CO(g)+H2O(g) ��H3
�ش��������⣺
��֪��Ӧ������صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C | H��O | C��H |
E/��kJ��mol-1�� | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼�����H1=___kJ��mol-1����֪��H2=-58kJ��mol-1������H3=___kJ��mol-1��
���𰸡�CH3OH(l)+3/2O2(g)�TCO2(g)+2H2O��l�� ��H=��725.76kJmol��1 N2(g)+2O2(g)=2NO2(g) ��H=+67.8kJmol��1 N2(g)+3H2(g)=2NH3(g) ��H=-92kJmol��1 -99 +41
��������
���ʵ��������������ȣ��ʱ���ڶ��ѻ�ѧ�����յ�������ȥ�ɼ��ͷŵ�������������ʵ�״̬���ʱ�����д�Ȼ�ѧ����ʽ���ݴ˷����ڣ�1������2������3���ʣ���Ӧ��=��Ӧ���ܼ����������ܼ��ܣ���ϸ�˹���ɽ������ڣ�4���ʡ�
��1��1gҺ̬�״�(CH3OH)ȼ������CO2��Һ̬ˮʱ����22.68 kJ����֪1molҺ̬�״�(CH3OH)ȼ������CO2��Һ̬ˮʱ����22.68kJ��32=725.76kJ����״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH(l)+3/2O2(g)�TCO2(g)+2H2O(l) ��H=��725.76kJmol��1��
��2��������N2��O2��ȫ��Ӧ��ÿ����23gNO2��Ҫ����16.95kJ������2mol����������Ӧ�ų�����
![]() 2=67.8 kJ����Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+2O2(g)=2NO2(g) ��H=+67.8kJmol��1��
2=67.8 kJ����Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+2O2(g)=2NO2(g) ��H=+67.8kJmol��1��
��3����ѧ��Ӧ���ʱ���ڷ�Ӧ��ļ���֮�ͼ�ȥ������ļ���֮�ͣ���N2(g)+3H2(g)=2NH3(g) ��H����946 kJ��mol��1+3��436 kJ��mol��1-6��391 kJ��mol��1��=��92 kJ��mol��1��
��4����H1=1076 kJ��mol-1+2��436 kJ��mol-1(3��413+343+465) kJ��mol-1=99 kJ��mol-1��
���ݸ�˹���ɣ�����=�ۣ�����H3=��H2��H1=58 kJ��mol-1(99 kJ��mol-1)=+41 kJ��mol-1��
�ʴ�Ϊ��99��+41��

 ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д�����Ŀ���������ƣ�Na2FeO4���Ǿ�����ɫ����ķ�ĩ����һ�ָ�Ч��ɫǿ�������������������ȶ��������ڷ�ˮ��������ˮ�Ĵ�����ʵ������ʯī������Ϊ�缫���Բ�ͬŨ�ȵ�NaOH��ҺΪ�������Һ������һ����ѹ����Ʊ��������ƣ����װ�ú�����������
c(NaOH) | �������� | �������� |
1 mol��L��1 | ������ɫ���� | ������ɫ���壬10min����Һ��ɫ�����Ա仯 |
10 mol��L��1 | ����������ɫ���� | ����������ɫ���壬3min����Һ��Ϊdz�Ϻ�ɫ��������� |
15 mol��L��1 | ����������ɫ���� | ����������ɫ���壬1min����Һ��Ϊdz�Ϻ�ɫ��������� |
����˵������ȷ����

A. aΪ������bΪʯī
B. ������Ҫ������Ӧ��2H2O + 2e��=== H2��+ 2OH��
C. ��Ũ�ȵ�NaOH��Һ�������ڷ���Fe��6e��+ 8OH��=== FeO42��+ 4H2O
D. �Ʊ�Na2FeO4ʱ�����ñ���NaCl��Һ������Ч����������������