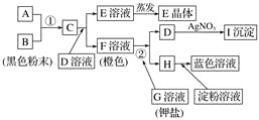
题目内容
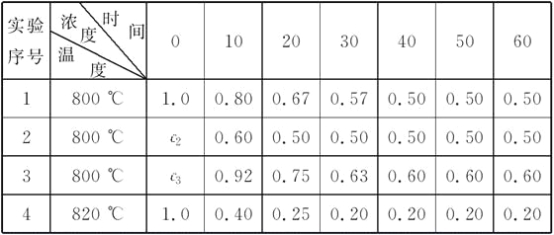
【题目】某化学反应:2A![]() B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20 min时间内A的平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=__________mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是
________________________________________________________________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1(填“>”、“=”或“<”),且c3________1.0 mol·L-1(填“>”、“=”或“<”)。
(4)比较实验4和实验1,可推测该反应是________反应(选填“吸热”或“放热”)。理由是
________________________________________________________________________。
【答案】0.013 1.0 使用了催化剂 > > 吸热 温度升高时,平衡向右移动
【解析】
(1)v(A)=![]() =0.013 mol·L-1·min-1。
=0.013 mol·L-1·min-1。
(2)对比实验1与实验2可知,平衡时A的浓度相等,确定1、2为等效平衡,即c2=1.0 mol·L-1,且2先达平衡状态,反应的速率快,说明反应中使用了催化剂。
(3)对比实验3与实验1可知,从10 min到20 min,实验1的A的浓度变化值为0.13 mol·L-1,而实验3的A浓度变化值为0.17 mol·L-1,这就说明了v3>v1。又知从0 min 到10 min A的浓度变化值应大于0.17 mol·L-1,即c3>(0.92+0.17) mol·L-1=1.09 mol·L-1。
(4)对比实验4与实验1可知,两实验的起始浓度相同,反应温度不同,达平衡时实验4中A的浓度小,说明了实验4中A进行的程度大,即温度越高,A的转化率越大,说明正反应为吸热反应。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___。
(2)25℃、101kPa若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量___。
(3)25℃、101kPa已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___。
(4)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O | C | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=___kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=___kJ·mol-1。