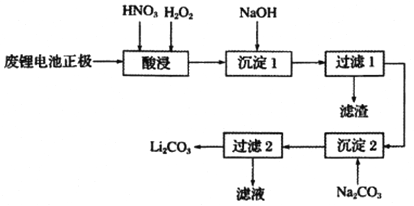
题目内容
【题目】 第三周期元素,浓度均为0.01 mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是
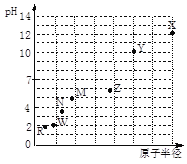
A. 气态氢化物的稳定性:N>R
B. Z的最高价氧化物对应的水化物能溶于稀氨水
C. Y和R形成的化合物既含离子键又含共价键
D. X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
【答案】D
【解析】
试题第三周期元素的原子半径随原子序数的递增而减小,即X→R为Na→Cl。A项中,气态氢化物的稳定性:HCl>PH3,故N>R不正确;B.Z的最高价氧化物对应的水化物Al(OH)3不能溶于弱碱稀氨水;C.Y和R形成的化合物是MgCl2,只含离子键,不含共价键;D.X和M两者最高价氧化物对应的水化物反应后溶液含Na2SiO3,水解溶液的pH>7。

练习册系列答案
相关题目
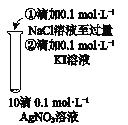
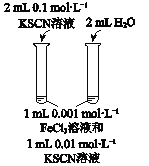
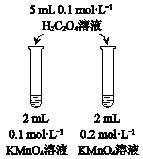
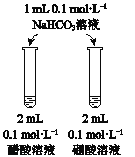
【题目】下列实验方案不能达到相应目的是
A | B | C | D | |
目的 | 比较AgCl和AgI的溶解度大小 | 研究浓度对化学平衡的影响 | 研究浓度对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. A B. B C. C D. D