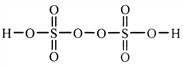
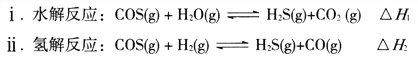��Ŀ����
����Ŀ������ʵ����Ҫ�������ʵ���Ũ��Ϊ0.1 mol/L��NaOH��Һ480 mL
��1�������
����ʱӦ����NaOH������/g | �Ѹ����� | ����ʱ���Ѹ��������Ҫ���������� |
__________ | �ձ���ҩ�ס�������ƽ | ____________________________ |
��2����Ҫ�������Һ���ʵ���������������Ҫ��һ��������______________(������˵������
��3�����в��������Ƶ�NaOH��ҺŨ����ƫ��Ӱ�����_________________������ĸ��
A������NaOH����ʱ��¶���ڿ�����ʱ�����
B��ѡ�õ�����ƿ��������������ˮ
C�����ձ����ܽ�NaOH��������������Һע������ƿ��
D���ڶ���ʱ��������ƿ�̶���
����ʵ��������ͼ����ʵ��װ�ã��ɿ�����ȡ�������壬�������������ʵ�顣

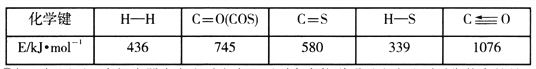
��1���� AΪ30%H2O2��Һ��BΪMnO2 ��Cʢ�������ᣨH2S��������Һ������E��C�г���dz��ɫ���ǵ�����д��C�з�����Ӧ�Ļ�ѧ����ʽ��______________________________________��
��2����A��װ��Ũ���ᣬB��װ�й���KMnO4 ��C��ʢ��KI������Һ������E��B�г��ֻ���ɫ���塣��֪1 mol KMnO4������Ӧʱת��5mol���ӡ���B�з�����Ӧ�����ӷ���ʽ�ǣ�_______��C�е������ǣ�___________��
���𰸡�2.0 500 mL����ƿ������������ͷ�ιܡ���Ͳ ����Һ���ܶ� C 2H2S + O2 = S��+ 2H2O 2MnO4-+16H+ + 10Cl- =2Mn2+ +5Cl2��+8H2O ��ɫ��Һ��Ϊ��ɫ
��������
������1��ʵ����Ҫ�������ʵ���Ũ��Ϊ0.1 mol/L��NaOH��Һ480 mL����Ҫѡ��500mL ������ƿ�������ã�����500mL 0.1mol/L��NaOH��Һ��Ҫ�������ƹ����������0.5L��0.1mol/L��40g/mol=2.0g���ܽ��ת��Һ��ʱ����Ҫ�����������ݻ���Ҫ��ͷ�ιܣ�����ƿ����Ҫ500ml�ģ��������ȡ����ˮ����Ͳ��
��2�����ʵ���������=���ʵ�����/��Һ��������������֪���ʵ���������������Һ���������˻���Ҫ֪����Һ���ܶȣ�
��3��A������NaOH����ʱ��¶���ڿ�����ʱ�������NaOH���տ����е�ˮ�Ͷ�����̼�����ʣ�����Ũ��ƫ�ף�
B��ѡ�õ�����ƿ��������������ˮ����Ӱ��Ũ�ȣ�
C�����ձ����ܽ�NaOH��������������Һע������ƿ�У����¶���ʱ���ƫС����˵���Ũ��ƫ��
D���ڶ���ʱ��������ƿ�̶��ߣ����¶������ƫ����˵�����ҺŨ��ƫС��
����������������ȷ��ΪC��
������1�����������ڶ������̵Ĵ�������������������������C�������ⷢ��������ԭ��Ӧ�������ʣ���Ӧ����ʽΪ2H2S + O2 = S��+ 2H2O��
��2��Ũ�����������ط�Ӧ������������֪1 mol KMnO4������Ӧʱת��5mol���ӣ���Mn��+7���½���+2�ۣ����ӷ�Ӧ����ʽΪ��2MnO4-+16H+ + 10Cl- =2Mn2+ +5Cl2��+8H2O��������C�еĵ⻯�ط�Ӧ���ɵⵥ�ʣ��ⵥ�ʿ�ʹ������Һ���������C�е���������ɫ��Һ������

 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�����Ŀ�����������ȷ���ǣ� ��
ѡ�� | ���� | �� | �� | ���� |
A | ˮ�� | ���� | ���� | ��������Һ |
B | ��ˮ | ���� | �ռ� | �� |
C | C60 | ���� | ��ʯ�� | �� |
D | ���� | ̼�� | ������ͭ | ������������ |
A.AB.BC.CD.D