题目内容
17.下列说法错误的是( )| A. | 热化学方程式未注明温度和压强时,△H表示标准状况下的数据 | |
| B. | 热化学方程式中各物质前的化学计量数不表示分子个数,只代表物质的量 | |
| C. | 同一化学反应,化学计量数不同,△H不同;化学计量数相同而状态不同,△H也不相同 | |
| D. | 化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比 |
分析 A.未注明温度和压强时,是指在25℃,101KPa条件下测定的数据;
B.热化学方程式中的化学计量数只表示物质的量,不表示微粒数,系数可以用分数表示;
C.△H为反应热,表示化学反应过程中放出或吸收的热量;对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比;
D.吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量,一个化学反应发生的条件与反应的热效应无关,与反应物的量有关.
解答 解:A.热化学方程式未注明温度和压强时,△H表示在25℃,101KPa条件下测定的数据,故A错误;
B.热化学方程式中的化学计量数只表示反应物或生成物的物质的量,不表示微粒数,系数可以用分数表示,故B正确;
C.化学反应的焓变(△H)只与反应体系的始态和终态有关,而与反应的途径无关,△H的单位是KJ/mol 与热化学方程式的化学计量数成正比,对于相同物质的反应,当化学计量数不同时,其△H 不同,与反应条件无关,所以同一化学反应反应条件不同,只要热化学方程式的化学计量数一定,△H值一定,故C正确;
D.化学反应放热、吸热关键看反应物和生成物所具有的总能量的相对大小或生成新化学键所释放的能量与断裂旧化学键所吸收的能量的相对大小,与化学反应发生的条件无关,化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比,故D正确;
故选A.
点评 本题主要考查了热化学方程式,掌握△H的含义以及与化学计量数间的关系是解答的关键,注意热化学方程式概念的运用,题目难度不大.

练习册系列答案
相关题目
8.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种用离子变换法回收钒的新工艺,回收率达到91.7%.
部分含钒物质在水中的溶解性如下表所示:
该工艺的主要流程如图所示:
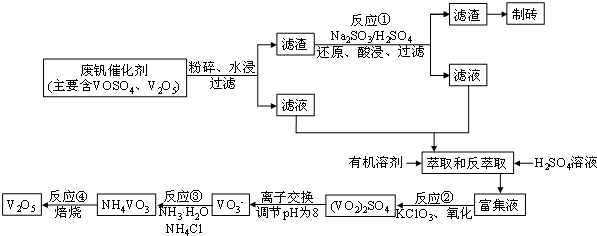
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为3V2O5+10Al 高温_6V+5Al2O3
用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c(填序号)
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O
(3)若反萃取使用硫酸用量过大,进一步处理会增加NH3•H2O(填化学式)的用途,造成成本增大.
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O=3(VO2)2SO4+KCl+3H2SO4,若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12:7,则废钒催化剂中VOSO4和V2O5的物质的量之比为3:2.
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式NH4++VO3-=NH4VO3↓
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O.
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O?充电放电V2++VO2++2H+
①放电时的正极反应为VO2++2H++e-═VO2++H2O
②充电时的阴极反应为V3++e-═V2+.
部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为3V2O5+10Al 高温_6V+5Al2O3
用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c(填序号)
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O
(3)若反萃取使用硫酸用量过大,进一步处理会增加NH3•H2O(填化学式)的用途,造成成本增大.
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O=3(VO2)2SO4+KCl+3H2SO4,若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12:7,则废钒催化剂中VOSO4和V2O5的物质的量之比为3:2.
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式NH4++VO3-=NH4VO3↓
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O.
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O?充电放电V2++VO2++2H+
①放电时的正极反应为VO2++2H++e-═VO2++H2O
②充电时的阴极反应为V3++e-═V2+.
2.以下互为同位素的是( )
| A. | 金刚石与石墨 | B. | D2与H2 | ||
| C. | CO与CO2 | D. | 3517Cl与3717Cl |
3.以下操作会使结果偏高的是( )
| A. | 在转移液体前容量瓶中有少量蒸馏水 | |
| B. | 定容摇匀后,液面已低于容量瓶刻度线,此时再加水 | |
| C. | 转移时有少许液体沿容量瓶外壁流到实验桌上 | |
| D. | 定容时俯视液面 |
4.使用单质铜制取硝酸铜,最适宜的方法是:( )
| A. | Cu+稀HNO3 | B. | Cu空气、△→CuO硝酸→Cu(NO3)2 | ||
| C. | Cu+浓HNO3 | D. | CuCl2→CuCl2AgNO3→Cu(NO3)2 |
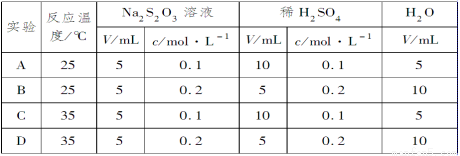
 ;
;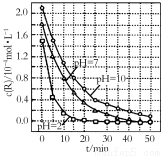
 强,R的降解速率越小
强,R的降解速率越小