题目内容
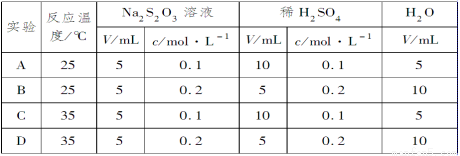
硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ +S↓ + H2O,下列各组实验中最先出现浑浊的是
练习册系列答案
相关题目
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间
浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
(Ⅰ)无催化剂、不加热 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 |
(Ⅱ)无催化剂、加热 | 360 | 480 | 540 | 720 |
(Ⅲ)MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
该小组在设计方案时,考虑了浓度、a:___________b:___________等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:_____________。
(2)将质量相同但颗粒大小不同的MnO2分别加入到5 mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂 (MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生反应的化学方程式:______________________。
②实验结果说明催化剂作用的大小与________________有关。
16.纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛.以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
(已知Ksp[Fe(OH)3]=3.8×10-38; Ksp[Cu(OH)2]=2×10-20;Ksp(ZnS)=1.6×10-24)
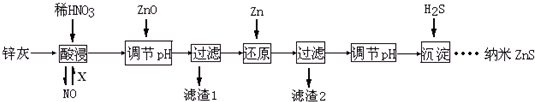
下列说法不正确的是( )
(已知Ksp[Fe(OH)3]=3.8×10-38; Ksp[Cu(OH)2]=2×10-20;Ksp(ZnS)=1.6×10-24)

下列说法不正确的是( )
| A. | 酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++NO${\;}_{3}^{-}$═3Fe3++NO↑+5H2O | |
| B. | 将酸浸的尾气循环利用,加入的X气体可以是O2 | |
| C. | 滤渣2中的成分和Zn和Fe | |
| D. | 当溶液中Zn2+浓度为小于1.0×10-5mol•L-1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2-浓度应大于1.6×10-19mol•L-1 |
17.下列说法错误的是( )
| A. | 热化学方程式未注明温度和压强时,△H表示标准状况下的数据 | |
| B. | 热化学方程式中各物质前的化学计量数不表示分子个数,只代表物质的量 | |
| C. | 同一化学反应,化学计量数不同,△H不同;化学计量数相同而状态不同,△H也不相同 | |
| D. | 化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比 |


 A2(g)+B2(g)达到平衡状态的标志是( )
A2(g)+B2(g)达到平衡状态的标志是( ) nmolA2的同时消耗n molAB
nmolA2的同时消耗n molAB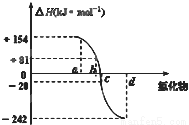
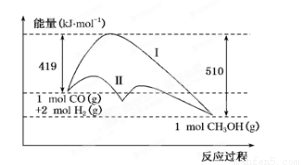
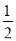 O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2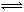 CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是