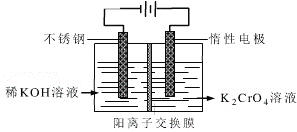
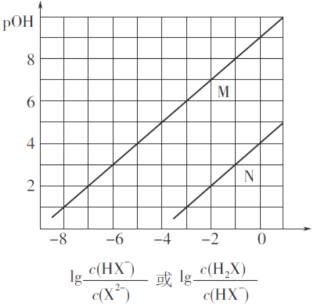
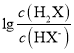题目内容
【题目】孔雀石的主要成分为Cu2(OH)2CO3。某同学设计的从孔雀石中冶炼铜的方案如下(假设孔雀石中杂质不溶于水和稀硫酸):

(1)反应①能观察到的现象是__________,有关反应的化学方程式为________。
(2)反应②加入的金属可能是______,有关反应的离子方程式为________。
【答案】固体逐渐消失,溶液由无色变成蓝色,有气泡产生 Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O 铁粉 Fe+Cu2+=Fe2++Cu
【解析】
(1)孔雀石的主要成分成为Cu2(OH)2CO3,为碱式盐,和硫酸反应生成二氧化碳气体,得到硫酸铜溶液;(2)硫酸铜溶液中加入过量铁发生氧化还原反应得到金属铜。据此解答。
(1)孔雀石中加入稀硫酸中能观察到的现象是孔雀石逐渐溶解,溶液由无色变为蓝色,且有气泡产生;反应的化学方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O;
(2)经过滤除去难溶于水和稀硫酸的杂质,则滤液中主要含有CuSO4,加入的金属粉末能将Cu2+从溶液中置换出来,故金属可能是Fe,反应的离子方程式为Fe+Cu2+=Fe2++Cu。

练习册系列答案
相关题目