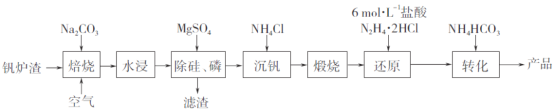
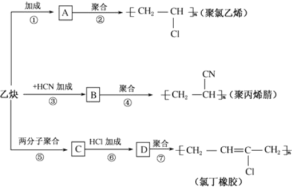
题目内容
【题目】铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶可制得硫酸铜晶体(装置如图1、2所示)。


(1)把浓硝酸分多次加入到铜粉与稀硫酸的混合物中的目的是_______________。
(2)图1烧瓶中发生反应的离子方程式为_____________________________________。
(3)图2是图1的改进装置,其优点除可以防止倒吸外还有:____________________________。
【答案】确保所有的硝酸都作氧化剂,在溶液中将铜氧化,以生成硫酸铜 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8H++2 NO3-=3Cu2++2NO↑+4H2O NO、NO2有毒气体能被完全吸收
【解析】
(1)多次加入到铜粉与稀硫酸的混合物中能使硝酸全部被还原;(2)铜粉与稀硫酸不反应,铜与浓硝酸反应;(3)改进前NO、NO2有毒气体不能被完全吸收。
(1)铜与硝酸反应生成硝酸铜、二氧化氮、一氧化氮和水,NO3-不能全部被还原,把浓硝酸分多次加入到铜粉与稀硫酸的混合物中能使硝酸全部被还原,故答案为:确保所有的硝酸都作氧化剂,在溶液中将铜氧化,以生成硫酸铜;
(2)将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,铜粉与稀硫酸不反应,铜与浓硝酸反应,Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,随着反应的进行,浓硝酸变成稀硝酸,稀硝酸和铜反应生成硝酸铜和一氧化氮、水:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)改进前,二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮有毒且和水不反应,所以NO、NO2有毒气体不能被完全吸收,且二氧化氮和氢氧化钠反应后,导管内压强减小,易产生倒吸现象;改进后,通入氧气,氧气、一氧化氮、二氧化氮、水反应完全生成硝酸被氢氧化钠吸收;且中间储气瓶有缓冲作用,防止倒吸。

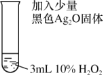
【题目】某小组探究清洗试管(内壁附着银镜)的反应原理,进行下列实验。
I.初步探究
(1)将稀硝酸加入附着银镜的试管中,记录现象如下:
实验Ⅰ | 实验操作 | 实验现象 |
| 银镜上出现气泡,在液面下方为无色气体,在试管口附近......;试管内壁上的银逐渐溶解。 |
①补全反应中的实验现象___。
②实验Ⅰ中银镜消失发生反应的化学方程式为____。
(2)为消除实验Ⅰ中氮氧化物的污染,将双氧水溶液加入附着银镜的试管中。
实验Ⅱ | 实验操作 | 实验现象 |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;试管内壁上的银逐渐溶解。 |
①由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能。该实验方案是:在反应后的液体中,加入___。
②查阅资料发现:该实验中银镜溶解后最终产物为颗粒很小(直径在1~100nm之间)的Ag,其分散在液体中,肉眼无法识别。该同学通过实验证实了这种可能性。他的操作及现象是:___。
③写出该实验Ⅱ中发生反应的化学方程式:___。
II.查阅资料,继续探究
查阅文献:Ag2O+4NH3H2O=2[Ag(NH3)2]++2OH-+3H2O
(3)探究Ag2O在H2O2分解反应中的作用,进行如下实验。
实验Ⅲ | 实验操作 | 实验现象 |
| 剧烈反应,产生大量的无色气体,同时在试管底部仍有少量黑色固体 |
根据实验Ⅲ的现象猜想:Ag2O在反应中作氧化剂。继续实验,在实验Ⅲ反应后的试管中加入足量的溶液x后,固体仍有剩余。由此验证了该猜想的正确。
①在实验中加入足量的溶液x是____。
②实验Ⅲ中发生反应的化学方程式为___。
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
【题目】下表是几种常用燃料(1mol)完全燃烧时放出的热量:
物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1367 |
(1)从热量角度分析,目前最适合家庭使用的优质气体燃料是___。
(2)写出管道煤气中的一氧化碳燃烧的热化学方程式___。
(3)充分燃烧1mol表中各种燃料,排放出二氧化碳的量最多的是___。
(4)矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有氢能、___等。