题目内容
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1Na2SO3溶液的pH约为10;0.1mol·L–1NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 |
【答案】AC
【解析】试题分析:A、室温下,向苯酚钠溶液中通入足量CO2,发生反应:![]() + CO2+ H2O
+ CO2+ H2O![]()
![]() + NaHCO3,说明碳酸的酸性比苯酚的强,A正确;B、硫酸钙为微溶物、硫酸钡为难溶物,均能形成白色沉淀,但题给实验无法判断二者的Ksp大小,B错误;C、室温下,向FeCl3溶液中滴加少量KI溶液,发生反应:2Fe3++2I–===2Fe2++I2,Fe3+的氧化性比I2的强,C正确;D、亚硫酸氢钠溶液显酸性,这说明亚硫酸氢根离子的电离程度大于其水解程度,因此题给实验说明HSO3–结合H+的能力比SO32–的弱,D错误。答案选AC。
+ NaHCO3,说明碳酸的酸性比苯酚的强,A正确;B、硫酸钙为微溶物、硫酸钡为难溶物,均能形成白色沉淀,但题给实验无法判断二者的Ksp大小,B错误;C、室温下,向FeCl3溶液中滴加少量KI溶液,发生反应:2Fe3++2I–===2Fe2++I2,Fe3+的氧化性比I2的强,C正确;D、亚硫酸氢钠溶液显酸性,这说明亚硫酸氢根离子的电离程度大于其水解程度,因此题给实验说明HSO3–结合H+的能力比SO32–的弱,D错误。答案选AC。

 小学生10分钟口算测试100分系列答案
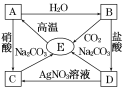
小学生10分钟口算测试100分系列答案【题目】氯化亚铜(CuC1)在化工、印染、电镀等行业应用广泛。CuCl微溶于水,不溶于醇和稀酸,可溶于Cl-浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuC1的工艺过程如图所示:

回答下列问题:
(1)步骤①中N元素被还原为最低价,写出此反应的离子方程式___________。
(2)步骤②中,亚硫酸铵要略保持过量,原因是___________,滤液中可循环利用的物质是___________。
(3)步骤⑤中,醇洗的目的是______________________。
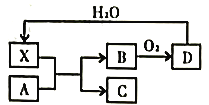
(4)常用K2Cr2O7溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品10.00g,将其置于过量的FeCl2溶液中,待样品完全溶解后,加入适量稀硫酸配成100mL溶液,取溶液10.00mL用0.1000mol·L K2Cr2O7溶液进行滴定,反应中Cr2O72-被还原成Cr3+,相关数据记录如下表所示:
实验编号 | 1 | 2 | 3 |
消耗K2Cr2O7溶液的体积/mL | 14.98 | 16.03 | 15.02 |
该样品中CuCl的质量分数___________。(保留4位有效数字)
(5)制造印刷电路板产生的废液中含大量[Cu(NH3)4]2+等离子,利用膜电解技术对此废液进行电解,电解装置如下图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到CuCl,电解时阴极的电极反应式为___________,生成CuCl的离子方程式为______________________。