题目内容
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)热分解法制氢。某温度,H2O(g) ![]() H2(g)+1/2O2(g)。该反应平衡常数表达式K=_____
H2(g)+1/2O2(g)。该反应平衡常数表达式K=_____
(2)热化学循环制氢。制备H2的反应步骤如下:
①Br2(g) + CaO(s) = CaBr2(s) + 1/2O2(g) ΔH=-73 kJ·mol-1
②3FeBr2(s) + 4H2O(g) = Fe3O4(s) + 6HBr(g) + H2(g) ΔH=+384 kJ·mol-1
③CaBr2(s) + H2O (g) = CaO(s) + 2HBr(g) ΔH=+212 kJ·mol-1
④Fe3O4(s)+8 HBr(g) = Br2(g) + 3FeBr2(s) + 4H2O(g) ΔH=-274 kJ·mol-1
则 H2O(g) ![]() H2(g)+1/2O2(g) ΔH =_________kJ·mol-1。
H2(g)+1/2O2(g) ΔH =_________kJ·mol-1。
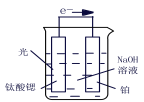
(3)光电化学分解制氢,钛酸锶光电极:4OH--4e- ![]() O2+2H2O,则铂电极的电极反应为_______。
O2+2H2O,则铂电极的电极反应为_______。
(4)水煤气法制氢。CO(g) + H2O(g) ![]() CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。
CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。
① 若升高温度到950℃时,达到平衡时K_________1(填“>”、“<”或 “=”)。
② 850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是_________。
(5)甲烷制氢。将1.0 mol CH4和2.0 mol H2O (g)通入容积为100 L的反应室,在一定条件下发生反应:CH4(g) + H2O (g)=CO (g) + 3H2(g)。测得达到平衡所需的时间为5 min,CH4的平衡转化率为50%,则用H2表示该反应的平均反应速率为_____。
(6)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质。该反应的化学方程式为_____。
【答案】K= 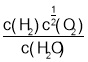 249 2H2O + 2e- = H2↑+ 2OH-(或2H++2e-=H2↑) < x< 3 0.003 mol·L-1· min-1 2LiBH4=2 LiH+2B+3H2↑
249 2H2O + 2e- = H2↑+ 2OH-(或2H++2e-=H2↑) < x< 3 0.003 mol·L-1· min-1 2LiBH4=2 LiH+2B+3H2↑
【解析】
(1)依据化学平衡常数的概念和化学方程式列式得到;
(2)依据盖斯定律和热化学方程式计算得到所需要的热化学方程式;
(3)用原电池原理和电极书写方法写出,依据装置图分析反应实质是电解水;
(4)①反应是放热反应,升高温度,平衡逆向进行,平衡常数减小;
②若要使上述反应开始时向正反应方向进行,浓度商小于平衡常数计算判断;
(5)依据甲烷的消耗量计算甲烷的化学反应速率,结合速率之比等于化学方程式中的计量数之比计算得到氢气表示的反应速率;
(6)依据分解产物配平书写化学方程式。
(1) 某温度下,H2O(g)H2(g)+![]() O2(g),该反应的平衡常数表达式为K=
O2(g),该反应的平衡常数表达式为K=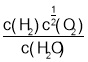 ;
;
(2)①Br2(g) + CaO(s) = CaBr2(s) + 1/2O2(g) ΔH=-73 kJ·mol-1,②3FeBr2(s) + 4H2O(g) = Fe3O4(s) + 6HBr(g) + H2(g) ΔH=+384 kJ·mol-1,③CaBr2(s) + H2O (g) = CaO(s) + 2HBr(g) ΔH=+212 kJ·mol-1,④Fe3O4(s)+8 HBr(g) = Br2(g) + 3FeBr2(s) + 4H2O(g) ΔH=-274 kJ·mol-1,则由盖斯定律①+②+③+④得到: H2O(g) ![]() H2(g)+1/2O2(g) ΔH=(-73 kJ·mol-1)+(+384 kJ·mol-1)+(+212 kJ·mol-1)+(-274 kJ·mol-1)=+249kJ·mol-1;
H2(g)+1/2O2(g) ΔH=(-73 kJ·mol-1)+(+384 kJ·mol-1)+(+212 kJ·mol-1)+(-274 kJ·mol-1)=+249kJ·mol-1;
(3) 钛酸锶光电极的电极反应为4OH--4e-═O2+2H2O,图分析可知反应的原理是电解原理的应用,实质是电解水,所以铂电极为阴极,氢离子得到电子生成氢气,则铂电极的电极反应2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑);
(4)①CO(g)+H2O(g)CO2(g)+H2(g)△H<0,在850℃时,K=1,反应是放热反应,温度升高平衡逆向进行,平衡常数减小,所以升高温度到950℃时,达到平衡时K<1;
②850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,说明此时的浓度商小于平衡常数,则Q=![]() =
=![]() <1,解得:x<3;
<1,解得:x<3;
(5)甲烷制氢。将1.0mol CH4和2.0mol H2O (g)通入容积为100L的反应室,在一定条件下发生反应,测得达到平衡所需的时间为5min,CH4的平衡转化率为50%,消耗甲烷物质的量=1.0mol×50%=0.50mol,甲烷表示的反应速率=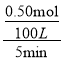 =0.001mol/Lmin,依据化学方程式:CH4(g)+H2O(g)=CO(g)+3H2(g),甲烷和氢气的反应速率之比等于1:3,则用H2表示该反应的平均反应速率为:0.003mol/Lmin;
=0.001mol/Lmin,依据化学方程式:CH4(g)+H2O(g)=CO(g)+3H2(g),甲烷和氢气的反应速率之比等于1:3,则用H2表示该反应的平均反应速率为:0.003mol/Lmin;
(6) LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质,依据物质组成分析,非金属单质只能是氢气和硼单质,反应的化学方程式为:2LiBH4═2LiH+2B+3H2↑。

 阅读快车系列答案
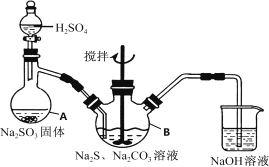
阅读快车系列答案【题目】甲、乙两同学为探究![]() 与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
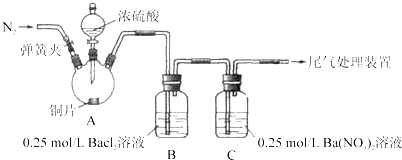
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡,B中有气泡冒出,产生大量白色沉淀,C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是_______,该沉淀的生成表明SO2具有_______性。
(3)C中液面上方生成浅棕色气体的化学方程式是______。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是____;乙在A、B间增加洗气瓶D,D中盛放的试剂是______。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____。