题目内容
【题目】肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图1。已知200 ℃时:
反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ/mol
反应Ⅱ:N2H4(g)+H2(g)=2NH3(g) ΔH2=-41.8 kJ/mol
下列说法不正确的是( )
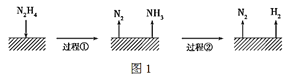
A.图1所示过程①是放热反应,②是吸热反应
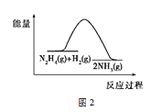
B.反应Ⅱ的能量过程示意图如图2所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为:N2H4(g)= N2(g)+2H2(g) ΔH=-50.7 kJ/mol
【答案】D
【解析】
A.由已知信息“反应Ⅰ”知,过程①为放热反应;根据盖斯定律:Ⅰ-2×Ⅱ得N2H4(g)= N2(g)+2H2(g) ΔH=-32.9 kJ/mol-2×(-41.8 kJ/mol)=+50.7 kJ/mol,过程②为吸热反应,故A正确,D错误;
B.反应Ⅱ为放热反应,反应物能量高于生成物能量,故B正确;
C.由反应Ⅰ知,断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量,故C正确;
故选D。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目