题目内容
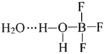
【题目】化合物M的结构如图所示,X、Y、Z、W是原子序数依次增大的短周期主族元素,其中W的核外电子数是Y的两倍。下列说法正确的是( )
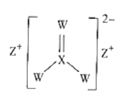
A.简单离子的半径:W>Z>Y
B.最简单氢化物的沸点:W>X>Y
C.Y、W均能和Z形成两种化合物
D.W的单质不能溶于XW2
【答案】C
【解析】
离子化合物M中Z为+1价且原子序数较大,则Z为Na;X形成4个共价键且原子序数最小,则X为C;根据化合价可知W显-2价,且W的原子序数最大,则W是S;W的核外电子数是Y的两倍,则Y为O;综上所述,X、Y、Z、W分别是C、O、Na、S,据此解答。
A.O2-和Na+核外有2个电子层,S2-核外有三个电子层,S2-半径最大,O2-的核电荷数比Na+小,则O2-的半径大于Na+的半径,即离子半径:W(S2-)>Y(O2-)>Z(Na+),A错误;
B.Y(O)的简单氢化物为H2O,常温下为液态,X(C)、W(S)的简单氢化物为CH4、H2S,二者常温下为气态,即Y(O)的简单氢化物沸点最高,B错误;
C.Y、W均能和Z形成两种化合物,即Na2O、Na2O2、Na2S、Na2S2,C正确;
D.W为S、X为C,W(S)单质易溶于XW2(CS2),D错误。
答案选C。

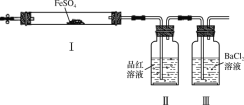
【题目】某溶液可能含OH-、SO42-、HCO3-、Cl-、Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液100mL进行以下实验:
(1)填写下表空格
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 加入过量HCl溶液,有气泡产生; | 肯定有___、肯定无___。 | HCO3-与OH-不共存 |
步骤二 | 步骤一中得到标况下的气体22.4L; | HCO3-的物质的量浓度为___mol/L | C元素守恒 |
步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,经过滤得到46.6g不溶于稀硝酸的沉淀。 | 肯定有___、___;肯定无___。 | 溶液显电中性;SO42-与Ba2+不共存会产生白色沉淀。 |
(2)步骤三过滤所需玻璃仪器有:烧杯、___、___。
(3)步骤一产生气泡的离子方程式为___,步骤三生成沉淀的离子方程式为:___。