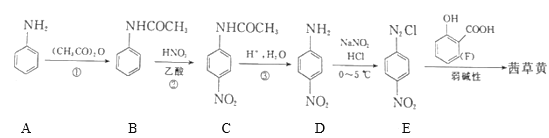
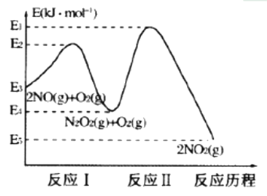
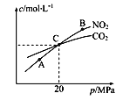
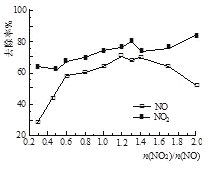
题目内容
【题目】常温时,l mol·L-1的HClO2和1 mol·L-1的HMnO4两种溶液,起始时的体积均为V0,分别向两溶液中加水稀释至体积为V,所得曲线如图所示。下列说法正确的是

A.当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B.在0≤pH≤5时,HMnO4溶液满足:pH=![]()
C.等pH的HClO2和HMnO4分别与足量Zn反应放出H2的体积HClO2>HMnO4
D.稀释前分别用l mol·L-1的NaOH溶液中和,消耗NaOH溶液的体积:HMnO4>HClO2
【答案】B
【解析】
两溶液加水稀释,溶液的酸性变弱,呈如图变化,又HClO2的酸性小于高锰酸,对应酸根离子ClO2-的水解程度更大,可据此判断溶液里面的微粒关系。
A.当稀释至pH均为3时,根据溶液中存在物料守恒c(H+)=c(OH-)+c(ClO2-)和c(H+)=c(OH-)+c(MnO4-)可以知道,c(ClO2-)= c(MnO4-),故A错误;
B.在0≤pH≤5时,不考虑水的电离,所以HMnO4溶液中的pH应该为:![]() ,故B正确;
,故B正确;
C.由图中曲线可以知道,酸性HClO2<HMnO4,pH和体积相同的HClO2与HMnO4溶液中,氢离子浓度相同,HClO2浓度大于HMnO4,所以与足量的Zn反应产生H2的量HClO2>HMnO4,但溶液体积未知,故无法比较,故C错误;
D.都是一元酸且物质的量相等,所以稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积应该相等,故D错误;
答案选B。

【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D