题目内容
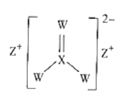
【题目】溴化钙是一种重要的化工原料,常见有![]() 和
和![]() 等结晶形式。某兴趣小组以废铁屑为原料制备
等结晶形式。某兴趣小组以废铁屑为原料制备![]() 的主要流程:
的主要流程:
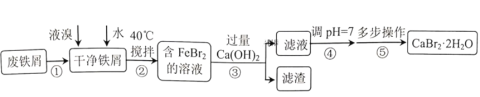
相关信息如下:
①![]() 吸湿性强。
吸湿性强。
②34℃时结晶得到![]() ,
,![]() 加热至210℃得到
加热至210℃得到![]() 。
。
请回答:
(1)步骤①的目的是去除废铁屑表面的油污,方法是________。
(2)实验室模拟海水提取溴的过程中,用苯萃取溶液中的溴,选出其正确操作并按顺序列出字母:涂凡士林→检漏→()→()→()→()→()→清洗干净。________
a.打开玻璃塞放气
b.打开旋塞放气
c.将溶液和苯转移至分液漏斗中,塞上玻璃塞
d.双手托住分液漏斗,右手压住玻璃塞,左手握住旋塞,上下颠倒振荡
e.右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转振荡
f.置于铁架台铁圈上静置,打开玻璃塞,将旋塞拧开,放出下层液体
g.从下口放出溴的苯溶液
h.从上口倒出溴的苯溶液
(3)步骤④调pH=7,适宜加入的试剂是________,通过调节分液漏斗的活塞可以控制添加液体的速率。当溶液pH接近7时,滴加试剂的分液漏斗的活塞应如图中的________(填序号)所示。

(4)下列有关说法正确的是________。
A.步骤②反应控制在40℃左右,原因是防止反应过于剧烈并减少液溴挥发
B.步骤③滤渣成分只有![]() 、
、![]() 和
和![]()
C.为使![]() 快速结晶,可用冰水浴进行冷却
快速结晶,可用冰水浴进行冷却
D.步骤⑤包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作
(5)制得的![]() 可以通过如下步骤测定其纯度:①称取样品质量;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤,洗涤,干燥;④称量。
可以通过如下步骤测定其纯度:①称取样品质量;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤,洗涤,干燥;④称量。
若实验操作规范而测定结果偏低,其可能的原因是________。
【答案】碱煮水洗(或碳酸钠溶液浸泡数分钟后水洗) cebfh 氢溴酸 ② A ![]() 吸水或可能混有
吸水或可能混有![]() (或洗涤时,有少量的碳酸钙溶解)
(或洗涤时,有少量的碳酸钙溶解)
【解析】
废铁屑表面常含有油污,可用碱性溶液浸泡、清洗除去,得干净铁屑,过量的干净铁屑和液溴、水反应得含FeBr2的溶液,FeBr2和过量的Ca(OH)2反应得到含CaBr2、Ca(OH)2的溶液和铁、![]() 、
、![]() 和
和![]() 的沉淀,过滤除去沉淀,滤液用HBr调pH到7得CaBr2溶液,将CaBr2溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得
的沉淀,过滤除去沉淀,滤液用HBr调pH到7得CaBr2溶液,将CaBr2溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得![]() 晶体,将
晶体,将![]() 晶体用油浴控制温度在210℃加热至恒重得
晶体用油浴控制温度在210℃加热至恒重得![]() 晶体。
晶体。
(1)油污主要成分为油脂,油脂在碱性环境下水解即可除去,可用碱煮水洗(或碳酸钠溶液浸泡数分钟后水洗),故答案为:碱煮水洗(或碳酸钠溶液浸泡数分钟后水洗);
(2)用苯萃取溴的操作依次为:涂凡士林、检漏、将溶液和苯转移至分液漏斗中,塞上玻璃塞、右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转振荡、打开旋塞放气、置于铁架台铁圈上静置,打开玻璃塞,将旋塞拧开,放出下层液体、从上口倒出溴的苯溶液,故答案为:cebfh;
(3)由分析可知,调pH前的滤液为含Ca(OH)2的CaBr2溶液,调pH的目的是除去Ca(OH)2,不能引入新的杂质,只能用氢溴酸。当溶液pH接近7时,用手控制活塞至微开状态,使液体一滴一滴的流下,当溶液pH为7时,迅速旋转活塞至关闭状态,即如图②所示,故答案为:氢溴酸;②;
(4) A.液溴与铁剧烈反应,同时液溴易挥发,为防止反应过于剧烈并减少液溴挥发,步骤②反应温度应控制在40℃左右, A正确;
B.步骤③滤渣成分除![]() 、
、![]() 和
和![]() 外,还有过量未反应的铁屑,B错误;
外,还有过量未反应的铁屑,B错误;
C.用冰水浴进行冷却,得到的是![]() 晶体,而不是
晶体,而不是![]() ,C错误;
,C错误;
D.步骤⑤包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥得![]() 晶体,将
晶体,将![]() 晶体用油浴控制温度在210℃加热至恒重得
晶体用油浴控制温度在210℃加热至恒重得![]() 晶体,D错误;
晶体,D错误;
故答案为:A;
(5)用过量Na2CO3将Ca2+转化为CaCO3沉淀,通过过滤,洗涤,干燥,称量,计算可得![]() 的实际质量,由纯度=
的实际质量,由纯度=![]() 可知,纯度偏低,可能是样品的质量偏高,比如
可知,纯度偏低,可能是样品的质量偏高,比如![]() 吸水或混有
吸水或混有![]() ,也可能是
,也可能是![]() 的实际质量偏小,如洗涤时,有少量的碳酸钙溶解,故答案为:
的实际质量偏小,如洗涤时,有少量的碳酸钙溶解,故答案为:![]() 吸水或可能混有
吸水或可能混有![]() (或洗涤时,有少量的碳酸钙溶解)。
(或洗涤时,有少量的碳酸钙溶解)。