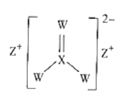
题目内容
【题目】某溶液可能含OH-、SO42-、HCO3-、Cl-、Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液100mL进行以下实验:
(1)填写下表空格
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 加入过量HCl溶液,有气泡产生; | 肯定有___、肯定无___。 | HCO3-与OH-不共存 |
步骤二 | 步骤一中得到标况下的气体22.4L; | HCO3-的物质的量浓度为___mol/L | C元素守恒 |
步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,经过滤得到46.6g不溶于稀硝酸的沉淀。 | 肯定有___、___;肯定无___。 | 溶液显电中性;SO42-与Ba2+不共存会产生白色沉淀。 |
(2)步骤三过滤所需玻璃仪器有:烧杯、___、___。
(3)步骤一产生气泡的离子方程式为___,步骤三生成沉淀的离子方程式为:___。
【答案】HCO3- OH- 10 SO42- Na+ Ba2+ 漏斗 玻璃棒 HCO3-+H+=CO2↑+H2O Ba2++SO42-=BaSO4↓
【解析】
步骤一:加入过量的HCl产生气泡,说明有HCO3-,则没有OH-;步骤二:HCl和HCO3-反应生成CO2 22.4L(标况),根据元素守恒可以推出原溶液中有1mol HCO3-,从而计算出HCO3-的物质的量浓度;根据步骤三可以推出原溶液中有SO42-,则溶液中无Ba2+,有Na+。
(1)步骤一:加入过量的HCl产生气泡,说明有HCO3-,则没有OH-,因为HCO3-与OH-不共存;步骤二:HCl和HCO3-反应生成CO2 22.4L(标况),n(CO2)=![]() =1mol,则n(HCO3-)=1mol,故c(HCO3-)=
=1mol,则n(HCO3-)=1mol,故c(HCO3-)=![]() =10mol/L;步骤三:根据题中信息,可以推出该沉淀为BaSO4,则n(BaSO4)=
=10mol/L;步骤三:根据题中信息,可以推出该沉淀为BaSO4,则n(BaSO4)=![]() =0.2mol,故原溶液中有0.2mol SO42-,则溶液中无Ba2+,有Na+;
=0.2mol,故原溶液中有0.2mol SO42-,则溶液中无Ba2+,有Na+;
(2)过滤所需玻璃仪器有:烧杯、漏斗、玻璃棒;
(3)步骤一产生气泡的离子方程式为HCO3-+H+=CO2↑+H2O;步骤三生成沉淀的离子方程式为:Ba2++SO42-=BaSO4↓。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D
【题目】合理利用资源成为当今研究热点。CH3NH2、PbI2及HI常用作合成太阳能电池的敏化剂甲胺铅碘(CH3NH3PbI3)的主要原料。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | E1 | E2 | E3 | E4 |
则上述热化学方程式中ΔH=___kJ·mol-1。
(2)可利用水煤气合成上述反应所需甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
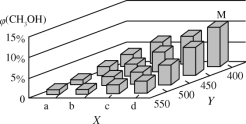
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②图中Y轴表示温度,其判断的理由是__。
(3)可利用四氧化三铅和氢碘酸反应制备难溶PbI2,若反应中生成amolPbI2,则转移电子的物质的量为___。
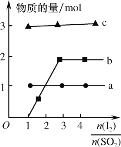
(4)将二氧化硫通入碘水制备HI的反应曲线如图所示,其反应原理为:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-![]() I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。