题目内容
【题目】某化学电源的工作原理如图。下列说法不正确的是( )

A. 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力
B. 通H2的电极作负极,发生氧化反应
C. 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O
D. 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能
【答案】C
【解析】A.多孔活性金属电极铂电极具有较强的吸附性,可增大电极接触面积,提高对气体的吸附能力,故A正确;B.氢氧燃料电池中,氢气失电子发生氧化反应,通氢气的电极为原电池的负极,故B正确;C.通入氧气的电极是原电池的正极,在碱性条件下,氧气得电子被还原,发生的电极反应为:O2+4e-+2H2O═4OH-,故C错误;D.燃料电池是将化学能转化为电能的装置,该装置也有部分的化学能转化为热能,故D正确;故选C。

练习册系列答案
相关题目
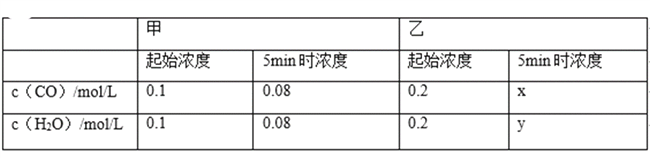
【题目】温度为T时,向2.0 L恒容密闭容器中充入2.0 mol X,反应X(g) ![]() Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(Y)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法不正确的是
A. 反应在前250 s的平均速率为v(Y)=0.000 8 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Y)=0.21 mol·L-1,则反应的ΔH>0
C. 相同温度下,起始时向容器中充入4.0 mol Y、4.0 mol Z,达到平衡时,则此反应的化学平衡常数为1/20
D. 相同温度下,若起始时向容器中充入2.0 mol X、0.40 mol Y和0.80 mol Z,则达到平衡前v(正)>v(逆)