题目内容
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol .L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
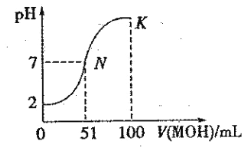
(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 _。
(2)常温下一定浓度的MA稀溶液的pH = a,则a 7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: ____________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________。
(4)K 点对应的溶液中,c(M+) +c(MOH) 2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) = mol· L-1。
【答案】(1)强、0.01 mol HA溶液中c(H+)=0.01 mol·L-1;
(2)<、M++H2O![]() MOH+H+、1×10-a mol·L-1;
MOH+H+、1×10-a mol·L-1;
(3)c(M+)>c(A-)>c(OH-)>c(H+);(4)=、0.005。
【解析】
试题分析:(1)假设HA为强酸,其c(H+)=0.01mol·L-1,根据pH的公式,pH=2,因此假设成立,HA为强酸;(2)假设MOH为强碱,两者恰好完全反应,消耗MOH的体积为100×10-3×0.01/0.02L=0.05L=50mL,根据图像加入51mLMOH达到pH=7,说明MOH属于弱碱,即MA的属于强酸弱碱盐,pH<7,M++H2O![]() MOH+H+、pH=a,推出c(H+)=10-amol·L-1,水电离出的c(OH-)=c(H+)=10-amol·L-1;(3)K点溶质为MOH、MA,M+水解程度微弱,因此c(M+)>c(A-),此溶液显碱性,c(OH-)>c(H+),根据图像数据,n(MA)>n(MOH),因此是c(M+)>c(A-)>c(OH-)>c(H+);(4)根据物料守恒,n(M+)+n(MOH)=100×10-3×0.02mol=0.002mol,n(A-)=100×10-3×0.01mol=0.001mol,因此有c(M+)+c(MOH)=2c(A-),根据溶液呈现电中性,c(M+)+c(H+)=c(OH-)+c(A-),根据物料守恒,c(M+)+c(MOH)=0.01mol·L-1,代入电中性的式子,推出c(MOH)+c(OH-)=0.01+c(H+)-c(A-)=0.01+10-10-0.005≈0.005mol·L-1。
MOH+H+、pH=a,推出c(H+)=10-amol·L-1,水电离出的c(OH-)=c(H+)=10-amol·L-1;(3)K点溶质为MOH、MA,M+水解程度微弱,因此c(M+)>c(A-),此溶液显碱性,c(OH-)>c(H+),根据图像数据,n(MA)>n(MOH),因此是c(M+)>c(A-)>c(OH-)>c(H+);(4)根据物料守恒,n(M+)+n(MOH)=100×10-3×0.02mol=0.002mol,n(A-)=100×10-3×0.01mol=0.001mol,因此有c(M+)+c(MOH)=2c(A-),根据溶液呈现电中性,c(M+)+c(H+)=c(OH-)+c(A-),根据物料守恒,c(M+)+c(MOH)=0.01mol·L-1,代入电中性的式子,推出c(MOH)+c(OH-)=0.01+c(H+)-c(A-)=0.01+10-10-0.005≈0.005mol·L-1。

 习题精选系列答案
习题精选系列答案