题目内容
19.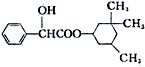 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )| A. | 该物质属于芳香烃 | |
| B. | 该有机物不能被氧化成醛 | |
| C. | 分子式为C17H23O3 | |
| D. | 1mol该物质最多可与2 mol NaOH发生反应 |
分析 该分子中含有醇羟基、酯基、苯环,具有醇、酯和苯的性质,能发生加成反应、氧化反应、水解反应、取代反应等,结合芳香烃的概念解答.
解答 解:A.该物质中除了含有C、H元素外还含有O元素,所以不属于芳香烃,故A错误;
B.该分子中醇羟基不位于边上,所以不能被氧化生成醛,能被氧化生成酮,故B正确;
C.根据结构简式知,分子式为C17H24O3,故C错误;
D.酯基水解生成的羧基能和NaOH反应,醇羟基和氢氧化钠不反应,所以1mol该物质最多可与1mol NaOH发生反应,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查醇、酯的性质,易错点是分子式确定,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
9.丙烯醛的结构简式为CH2=CH-CHO,下列叙述正确的是( )
| A. | 能使溴水褪色,不能使酸性KMnO4溶液褪色 | |
| B. | 在一定条件下,与等物质的量的氢气反应生成1-丙醇 | |
| C. | 能发生银镜反应,表现出氧化性 | |
| D. | 在一定条件下,能被氧化为丙烯酸 |
10.(1)A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
根据上述信息,写出B的基态原子核外电子排布式1s22s22p63s2,预测A和氯元素形成的简单分子空间构型为直线型.
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为[Co(Br)(NH3)5]SO4,中心离子的配位数为6.
(3)参考下表中的物质熔点回答下列问题
根据上表数据解释钠的卤化物及碱金属的氯化物的熔点变化规律随阴阳离子的半径增大,熔降低点.
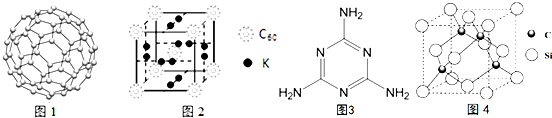
(4)C60可用作储氢材料.C60的结构如图1.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确不正确,并阐述理由C60是分子晶体,熔化时不需破坏化学键.科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为3:1.
 σ
σ
(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为$\frac{2π({b}^{3}+{c}^{3})}{3{a}^{3}}$×100%.(用含a、b、c的式子表示).
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为[Co(Br)(NH3)5]SO4,中心离子的配位数为6.
(3)参考下表中的物质熔点回答下列问题
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点(℃) | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
(4)C60可用作储氢材料.C60的结构如图1.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确不正确,并阐述理由C60是分子晶体,熔化时不需破坏化学键.科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为3:1.
 σ
σ(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为$\frac{2π({b}^{3}+{c}^{3})}{3{a}^{3}}$×100%.(用含a、b、c的式子表示).
7.下列是元素周期表的一部分
根据以上元素在周期表中的位置,用化学式填写空白.
(1)单质中氧化性最强的是F2,其电子式是 ;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是
;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是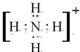 .
.
(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是NaOHAl(OH)3H3PO4HClO4;
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式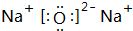 ,
,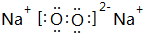 .其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
.其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | A | |||||||
| 二 | D | F | H | |||||
| 三 | B | C | E | G |
(1)单质中氧化性最强的是F2,其电子式是
 ;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是
;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是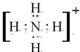 .
.(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是NaOHAl(OH)3H3PO4HClO4;
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式
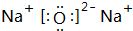 ,
, .其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
.其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
14.已知1~18号元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 氢化物的稳定性:H2Y<HZ | ||
| C. | 离子的还原性:Y2-<Z- | D. | 原子半径:r(X)<r(W) |
11.下列各组物质中,都是共价化合物的是( )
| A. | H2O2和CaF2 | B. | H2S和Na2O2 | C. | HNO3和HClO4 | D. | NH3和N2 |
2.下列说法正确的是( )
| A. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)该反应是熵减的反应 | |
| B. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率减慢 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 由H2(g)+1/2O2(g)═H2O(g)△H=-241.8 kJ•mol-1,得出H2的燃烧热是241.8 kJ•mol-1 |