题目内容
18.可逆反应2NO2?2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )| A. | 混合气体的颜色不再改变的状态 | |
| B. | 生成NO、O2的速率之比为2:1 | |
| C. | NO2、NO、O2的物质的量浓度比为2:2:1 | |
| D. | 混合气体的密度不再改变的状态 |
分析 平衡状态的两个重要特征上判断:(1)v(正)=v(逆),(2)混合物中各组成成分的百分含量不变,据此分析.
解答 解:此题列出了判断可逆反应是否达到平衡状态的各种可能情况,应从平衡状态的两个重要特征上判断(1)v(正)=v(逆),(2)混合物中各组成成分的百分含量不变.
A、NO2是红棕色气体,颜色不变时说明NO2的浓度保持不变,符合特征(2),故A正确;
B、反应速率之比始终等于化学计量数之比,所以用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态不一定是平衡状态,故B错误;
C、NO2、NO、O2的物质的量浓度比为2:2:1,不能说明正逆速率相同,不能证明反应达到平衡状态,故C错误;
D、容器中是恒容条件,气体质量不变,体积不变,则ρ始终不变,不能说明平衡状态,故D错误;
故选A.
点评 本题考查化学平衡状态的判断,难度不大,做题时注意分析化学方程式的前后计量数大小的关系.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
8.工业合成氨中常采用下列措施,其中不能用平衡移动原理解释的是( )
| A. | 使用铁触媒 | B. | 提高压强 | C. | 将氨液化分离 | D. | 增大N2浓度 |
9.碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g)+I2(?)═2HI(g);△H=-9.48kJ•mol-1
②H2(g)+I2(?)═2HI(g);△H=+26.48kJ•mol-1
下列判断正确的是( )
①H2(g)+I2(?)═2HI(g);△H=-9.48kJ•mol-1
②H2(g)+I2(?)═2HI(g);△H=+26.48kJ•mol-1
下列判断正确的是( )
| A. | ②的反应物总能量比①的反应物总能量低 | |
| B. | ①中的I2为固态,②中的I2为气态 | |
| C. | ①的产物比②的产物热稳定性更好 | |
| D. | 1mol固态碘升华时将吸热17kJ |
3.下列有关石油炼制和煤的利用的说法正确的是( )
| A. | 煤的气化、液化和干馏是物理变化 | |
| B. | 通过石油分馏得到的汽油是纯净物 | |
| C. | 石油裂解是为了得到乙烯、丙烯等气态短链烃 | |
| D. | 干馏的产物能提取出苯、甲苯等芳香烃,因为煤中含有苯和甲苯 |
10.近期埃博拉病毒在非洲各国肆虐,严重威胁了非洲人民的生命.在此期间,环境消毒是极其关键的,常常喷洒一种名为“84”的消毒液,其有效成分为NaClO.下列有关“84”消毒液的说法正确的是( )
| A. | NaClO属于共价化合物 | |
| B. | “84”消毒液在空气中久置会变质 | |
| C. | 1L 0.1mol?L-1NaClO溶液中ClO-的数目为0.1NA | |
| D. | ClO-与Ca2+、Fe2+、Al3+ 能大量共存 |
7.根据中学化学教材所附元素周期表及元素周期律判断,下列叙述正确的是( )
| A. | 在过渡元素中寻找半导体材料 | |
| B. | 元素周期表中第一列元素都是碱金属元素 | |
| C. | 现行元素周期表是按照元素相对原子质量又小到大的顺序排列 | |
| D. | M层电子为奇数的所有主族元素的族序数与该元素原子的M层电子数相等 |
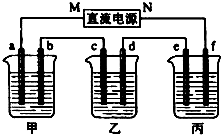 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: