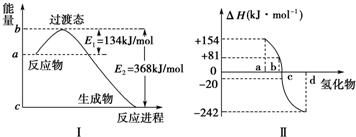
题目内容
8.工业合成氨中常采用下列措施,其中不能用平衡移动原理解释的是( )| A. | 使用铁触媒 | B. | 提高压强 | C. | 将氨液化分离 | D. | 增大N2浓度 |
分析 平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.
解答 解:A.催化剂只改变化学反应速率,不改变平衡移动,使用铁触媒不能用平衡移动原理解释,故A选;
B.N2+3H2?2NH3是一个反应前后气体体积减小的可逆反应,增大压强,平衡正向移动,所以可以用平衡移动原理解释,故B不选;
C.将氨液化分离,降低生成物浓度,平衡正向移动,所以可以用平衡移动原理解释,故C不选;
D.增大氮气浓度,平衡正向移动,所以可以用平衡移动原理解释,故D不选;
故选A.
点评 本题考查化学平衡移动原理,为高频考点,明确化学平衡移动原理内涵及适用范围是解本题关键,注意:平衡移动原理只适用于“改变条件时能引起平衡移动的化学反应”,题目难度不大.

练习册系列答案
相关题目
7.下列反应的离子方程式正确的是( )
| A. | 铜片与AgNO3溶液反应:Cu+Ag+=Cu2++Ag | |
| B. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸氢钠溶液和苛性钠溶液反应:HCO3-+OH-=CO32-+H2O | |
| D. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
8.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,11.2L的氧气所含的分子数为NA | |
| B. | 含Cl-数目为0.4NA的CaCl2溶液,CaCl2的物质的量浓度是0.2mol/L | |
| C. | 1.8gNH4+ 中含有的电子数为NA | |
| D. | 标准状况下,含NA个氮原子的N2 和N2O混合气体中,N2 的体积是5.6L |
16.欲除去下列物质中的少量杂质,请填写所用方法及化学方程式.
| 欲除去的少量杂质 | 方法或试剂 | 反应的化学方程式 |
| (1)Na2CO3固体中的NaHCO3 | ||
| (2)金属Mg中的Al | ||
| (3)NaOH溶液中的Na2CO3 | ||
| (4)CO2中的HCl气体 |
3.目前下列工艺过程没有直接使用离子交换技术的是( )
| A. | 硬水的软化 | B. | 电解饱和食盐水制造NaOH | ||
| C. | 电渗析淡化海水 | D. | 海水中提取金属Mg |
13.下列装置或操作能达到实验目的是( )
| A. | 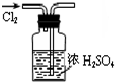 干燥Cl2 | B. | 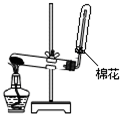 实验室制取并收集NH3 | ||
| C. | 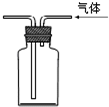 利用排空法收集CO2 | D. |  石油的分馏 |
17.将一定量的有机物充分燃烧后的产物,通入足量的石灰水完全吸收,经过滤得沉淀30g,滤液的质量比原有石灰水的质量减少11.4g(假定不考虑操作过程中的损耗),该有机物可能是( )
| A. | 乙酸乙酯 | B. | 乙醇 | C. | 乙二醇 | D. | 丙三醇 |
18.可逆反应2NO2?2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
| A. | 混合气体的颜色不再改变的状态 | |
| B. | 生成NO、O2的速率之比为2:1 | |
| C. | NO2、NO、O2的物质的量浓度比为2:2:1 | |
| D. | 混合气体的密度不再改变的状态 |