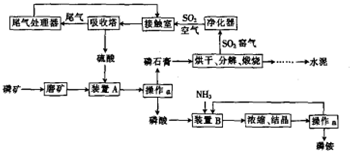
题目内容
8.依据原电池原理,设计番茄电池并检测电流的产生,其中合理的是( )| A. |  | B. | 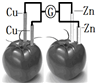 | C. | 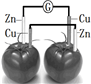 | D. | 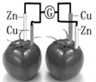 |
分析 依据原电池原理分析,原电池组成条件是活泼些不同的电极,电解质溶液和闭合回路及其自发进行的氧化还原反应.
解答 解:A、两个电极材料相同,不能形成了原电池反应,故A错误;
B、两个电极材料相同,不能形成了原电池反应,故B错误;
C、两个电极材料为活泼些不同的金属,番茄中也含有电解质溶液,又形成了闭合回路,能形成了原电池反应,能检测电流的产生,故C正确;
D、两个电极材料为活泼性不同的金属,番茄中也含有电解质溶液,又形成了闭合回路,能形成了原电池反应,但电流计不能检测电流的产生,故D错误;
故选C.
点评 本题考查了原电池构成条件的分析应用,主要是否形成原电池的分析,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
18.可逆反应2NO2?2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
| A. | 混合气体的颜色不再改变的状态 | |
| B. | 生成NO、O2的速率之比为2:1 | |
| C. | NO2、NO、O2的物质的量浓度比为2:2:1 | |
| D. | 混合气体的密度不再改变的状态 |
19.人造地球卫星用到的一种高能电池--银锌蓄电池,其电极反应为:Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-.据此判断,氧化银是( )
| A. | 正极,被还原 | B. | 正极,被氧化 | C. | 负极,被还原 | D. | 负极,被氧化 |
16.下列溶液中的c(Cl-)与50mL 1mol/L FeCl3溶液中的c(Cl-)相等的是( )
| A. | 1 mol/L NaCl溶液 | B. | 2 mol/L NH4Cl溶液 | ||
| C. | 1.5 mol/L MgCl2溶液 | D. | 2 mol/L AlCl3溶液 |
3.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 5.6 g 铁在足量氯气中燃烧,转移电子数为0.2 NA | |
| B. | 1mol H3O+所含的电子数为11NA | |
| C. | 71 g氯气与足量铁反应得到的电子数一定为2NA | |
| D. | 16 g O2和O3的混合气体中,含O2分子数为0.5NA |
20.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加C的量 | B. | 将容器的体积缩小一半 | ||
| C. | 保持体积不变,充入H2O(g) | D. | 保持压强不变,充入N2 |
18.我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应反应产生电流.电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列判断不正确的是( )
| A. | 电池工作时,电子由铝板沿导线流向铂网 | |
| B. | 铂电极做成网状,可增大与氧气的接触面积 | |
| C. | 正极反应为:O2+H2O+2e-═2OH- | |
| D. | 该电池通常只需要更换铝板就可继续使用 |