题目内容
13.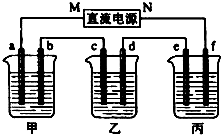 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:(1)电极b上发生的电极反应为4OH--4e-=2H2O+O2↑.
(2)电极b上生成的气体在标状况下的体积为5.6 L,此时甲烧杯中NaOH溶液的物质的量浓度为(设溶液的密度为1g/cm3)1.5mol/L.
(3)电极c的质量变化是32g,欲使电解后乙中的电解液恢复到起始状态,应该向溶液中加入适量的C(填字母编号).
A.Cu(OH)2 B.Cu2O C.CuCO3 D.Cu2(OH)2CO3
(4)其他条件不变,如果把乙装置改为电解精炼铜,则c电极的材料为精铜或纯铜,d电极的材料为粗铜.
分析 乙为足量的CuSO4溶液,接通电源,经过一段时间后,乙中c电极质量增加,由此可知c为电解池的阴极,则d为阳极,M为负极,N为正极,a为阴极,
b为阳极,e为阴极,f为阳极,电解池工作时,阳极发生氧化反应,阴极发生还原反应,结合电解规律和离子的放电顺序可解答该题.
解答 解:(1)甲为5.51%的NaOH溶液,b为阳极,阳极上氢氧根离子放电生成氧气,电极方程式为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(2)丙为200g10.00%的K2SO4溶液,通电时为电解水,其中m(K2SO4)=200g×10.00%=20g,
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,设溶液的质量为m,则m×10.47%=20g,m=191g,电解水的质量为200g-191g=9g,n(H2O)=0.5mol,
由2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑可知转移电子1mol电子,
电极b方程式为4OH--4e-=2H2O+O2↑,转移1mol电子,生成0.25molO2,体积为5.6L,
甲也为电解水的电解装置,应减少水9g,则电解后NaOH溶液的质量为109g-9g=100g,体积为0.1L,
又n(NaOH)=$\frac{109g×5.51%}{40g/mol}$=0.15mol,
则c(NaOH)=$\frac{0.15mol}{0.1L}$=1.5mol/L,
故答案为:5.6 L;1.5mol/L;
(3)电极c反应为Cu2++2e-=Cu,转移1mol电子生成0.5molCu,质量为32g,
电解硫酸铜溶液时阳极生成氧气,阴极生成铜,则欲使电解后乙中的电解液恢复到起始状态,应该向溶液中加入适量的CuCO3,
故答案为:32; C;
(4)把乙装置改为电解精炼铜,阴极应为纯铜,阳极为粗铜,故答案为:精铜或纯铜;粗铜.
点评 本题考查了原电池原理以及物质的量的有关计算,根据转移电子数相等来分析解答即可,难度不大,注意电极方程式的书写,为解答该题的关键.

| A. | 硬水的软化 | B. | 电解饱和食盐水制造NaOH | ||
| C. | 电渗析淡化海水 | D. | 海水中提取金属Mg |
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 乙醇分子中含有醛基 | |
| C. | 75%的乙醇溶液常用于医疗消毒 | |
| D. | 只用水就能鉴别苯和四氯化碳 |
| A. | 混合气体的颜色不再改变的状态 | |
| B. | 生成NO、O2的速率之比为2:1 | |
| C. | NO2、NO、O2的物质的量浓度比为2:2:1 | |
| D. | 混合气体的密度不再改变的状态 |
①CH3OH(g)?CO(g)+2H2(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)在容积为1.00L的容器中,通入一定量的甲醇发生反应①.100℃时,体系中各物质浓度随时间变化如图1所示(平衡时甲醇的转化率记作a1).
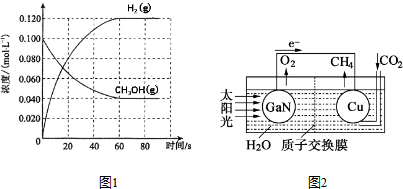
①在0-60s时段,反应速率v(CO)为0.001mol/(L•s)②;该反应的平衡常数K1 的计算式为$\frac{c(CO)c{\;}^{2}(H{\;}_{2})}{c(CH{\;}_{3}OH)}$.
②已知若在恒压条件下进行,平衡时CH3OH的转化率a2大于a1(填“大于”或“小于”、“等于”),判断理由是因为该反应为体积增大的反应,所以恒压相当于在恒容的基础上减小压强,平衡正向移动.
(3)合成CH4的原理:CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162kJ•mol-1.其他条件相同,实验测得在T1和P1与T2和P2条件下该反应的H2平衡转化率相同,若T1>T2,则P1>P2(填“>”、“<”或“=”).
(4)科学家用氮化镓材料与铜组装如图2所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4①写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O;.
②为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(选填“盐酸”或“硫酸”).
(5)标准状况下,将22.4L的甲烷完全燃烧生成的CO2通入到0.1L 1mol•L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
| A. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 0.1mol•L-1的HCl溶液:Ca2+、Na+、ClO-、NO3- |
| A. | 5.6 g 铁在足量氯气中燃烧,转移电子数为0.2 NA | |
| B. | 1mol H3O+所含的电子数为11NA | |
| C. | 71 g氯气与足量铁反应得到的电子数一定为2NA | |
| D. | 16 g O2和O3的混合气体中,含O2分子数为0.5NA |