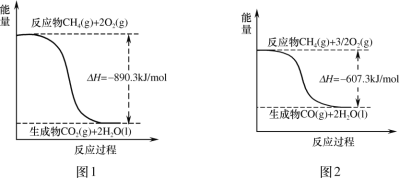
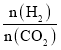��Ŀ����
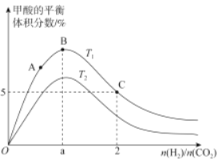
����Ŀ����1.0 L�����ܱ������з���0.10 mol X����һ���¶��·�����Ӧ��X(g)![]() Y(g)��Z(g) ��H��0��������������ѹǿp�淴Ӧʱ��t�ı仯��ϵ��ͼ��ʾ�����·�����ȷ���� ( )
Y(g)��Z(g) ��H��0��������������ѹǿp�淴Ӧʱ��t�ı仯��ϵ��ͼ��ʾ�����·�����ȷ���� ( )

A. ���¶��´˷�Ӧ��ƽ�ⳣ��K��3.2
B. �ӷ�Ӧ��ʼ��t1ʱ��ƽ����Ӧ����v(X)��0.2/t1 mol��L��1��min��1
C. �����ƽ����ϵ��Y�İٷֺ������ɼ���һ������X
D. �����������䣬�ٳ���0.1 mol����X��ƽ�������ƶ���X��ת���ʼ���
���𰸡�D
��������
X(g)![]() Y(g)��Z(g)
Y(g)��Z(g)
��ʼ 0.1 0 0
�仯 b b b
t1minĩ 0.1-b b b
����ѹǿ�ȵ������ʵ����ȣ�![]() ��b=0.04��
��b=0.04��
X(g)![]() Y(g)��Z(g)
Y(g)��Z(g)
��ʼ 0.1 0 0
ת�� a a a
ƽ�� 0.1-a a a
����ѹǿ�ȵ������ʵ����ȣ�![]() ��a=0.08��
��a=0.08��
A. ���¶��´˷�Ӧ��ƽ�ⳣ��K��![]() 0.32����A����
0.32����A����
B. �ӷ�Ӧ��ʼ��t1ʱ��ƽ����Ӧ����v(X)![]() ��0.04/t1 mol��L��1��min��1����B����
��0.04/t1 mol��L��1��min��1����B����
C.�������м���һ������X���൱�ڼ�ѹ��Y�İٷֺ�����С����C����
D. �����������䣬�ٳ���0.1 mol����X��ƽ�������ƶ��� ������X��ת���ʣ��൱�ڼ�ѹ��X��ת���ʼ��٣���D��ȷ��

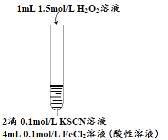
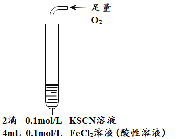
����Ŀ��ijС����Fe2+����ʵ���й۲쵽�쳣����Ϊ̽������ɫ��ȥ����ԭ��������ʵ�飺
��� | ʵ��I | ʵ��II | ʵ��III |
ʵ�鲽�� |
| ��ʵ��I��ɫ�����Һ�����ݷֱ����ʵ��
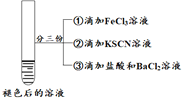
| Ϊ��һ��̽������ɫ��ȥ����ԭ���ֽ�������ʵ�� �� ��ȡ��Ӧ�����Һ���μ������BaCl2��Һ |
���� | ��Һ�ȱ�죬Ƭ�̺��ɫ��ȥ�����������ɣ�������ΪO2�� | ������������ ����Һ��� �۲�����ɫ���� | ����Һ��죬һ��ʱ�����ɫ�� ���ް�ɫ�������� |
������������ʵ�飬������������ȷ����
A.�ڴ�ʵ��������H2O2����Fe2�������ʱ�����SCN�������ʿ�
B.ͨ��ʵ����Ƴ�ʵ����к�ɫ��ȥ��ԭ��������SCN��������
C.ͨ��ʵ����ʵ���Ա��Ƴ���ɫ��ȥֻ��H2O2���������й�
D.����������ʵ����к�ɫ��ȥ��ԭ���뻯ѧƽ���ƶ�ԭ����