题目内容
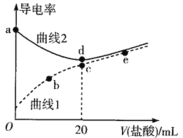
【题目】乙醇是重要的有机化工原料,可由乙烯水合法生产,反应的化学方程式如下:C2H4(g)+ H2O(g)![]() C2H5OH(g),下图为乙烯的平衡转化率与温度(T)、压强(P)的关系[起始n(C2H4)∶n(H2O) =1∶1]。下列有关叙述正确的是
C2H5OH(g),下图为乙烯的平衡转化率与温度(T)、压强(P)的关系[起始n(C2H4)∶n(H2O) =1∶1]。下列有关叙述正确的是
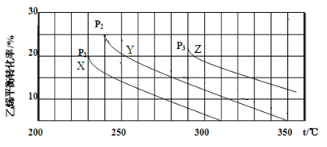
A. Y对应的乙醇的质量分数为1/9
B. X、Y、Z对应的反应速率:υ(X) > υ(Y) > υ(Z)
C. X、Y、Z对应的平衡常数数值:KX > KY > KZ
D. 增大压强、升高温度均可提高乙烯的平衡转化率
【答案】C
【解析】
A据图可知,Y点对应乙烯的平衡转化率为20%,起始n(C2H4) : n(H2O)=1:1,设C2H4和H2O的起始物质的量均为1mol,根据三段式法有:
C2H4(g)+ H2O(g)![]() C2H5OH(g)
C2H5OH(g)
起始(mol) 1 1 0
转化( mol) 0.2 0.2 0.2
平衡(mol) 0.8 0.8 0.2
则平衡时乙醇的质量分数为:![]() =
=![]() ,选项A错误;
,选项A错误;
B.因该反应是气体体积减小的可逆反应,所以温度相同时,压强越大,乙烯的平衡转化率越大,则结合图象可得: P1<P2<P3,且X、Y、Z三点对应的温度越来越高,所以X、Y、Z对应的反应速率: v (X) < v (Y < v (Z),选项B错误;
C. 据图可知,升高温度,乙烯的平衡转化率降低,说明该反应为放热反应,升高温度平衡逆向移动,平衡常数减小,则X、Y、Z对应的平衡常数数值: KX> KY>KZ,选项C正确;
D.因该反应是气体体积减小的可逆反应,则温度相同时,压强越大,乙烯的平衡转化率越大,又因该反应是放热反应,升高温度平衡逆向移动,乙烯的平衡转化率降低,选项D错误。
答案选C。

练习册系列答案
相关题目