题目内容
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol
若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式____________。
,请写出此反应的热化学方程式____________。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_________________________。
(3)NO2用氨水吸收能生成NH4NO3,25℃时,将amolNH4NO3溶于水配成bL溶液,溶液显酸性,常温下向该溶液通入标准状况下VL氨气后溶液呈中性,则通入氨气的过程中水的电离平衡将_____(填“正向”“不”“逆向”)移动,通入标准状况下氨气的体积为_________L(设通入氨气后溶液的体积不变,用含a的代数式表示,已知常温下NH3·H2O的电离平衡常数为2.0×10-5)
(4)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
5N2+6H2O不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
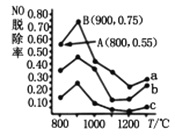
①由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是________。
②曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________mg/(m3·s)。
③曲线c对应NH3与NO的物质的量之比是____________。
【答案】2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=–746.5kJ/mol HNO2-2e-+H2O=NO3-+3H+ 逆向
N2(g)+2CO2(g) △H=–746.5kJ/mol HNO2-2e-+H2O=NO3-+3H+ 逆向 ![]() 或0.112a 催化剂活性下降 1.5×10-4 1:3
或0.112a 催化剂活性下降 1.5×10-4 1:3
【解析】
(1)根据化学平衡常数的含义书写相应的化学反应方程式,然后根据盖斯定律将已知的三个热化学方程式进行叠加就可以得到待求反应的热化学方程式;
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该溶液,电解该溶液得到较浓的硝酸,说明是NO2-失去电子,发生还原反应,据此书写发生的电极反应;
(3)NH4NO3是强酸弱碱盐,在溶液中由于NH4+水解使溶液显酸性,向该溶液中通入氨气,导致NH3H2O浓度增大,根据盐水解平衡分析判断;先计算溶液中c(NH4+),利用电离平衡常数表达式计算出c(NH3H2O),NH3+H2O![]() NH3H2O,利用物质的量与气体体积关系计算;
NH3H2O,利用物质的量与气体体积关系计算;
(4)①根据温度与催化剂的活性关系分析判断;
②根据NO的脱除量变化值和脱除时间计算NO的脱出速率;
③两种反应物存在的反应,增大一种反应物的量可提高另一种反应物的转化率,据此分析。
(1)由于化学平衡常数是可逆反应达到化学平衡状态时,生成物浓度幂之积与反应物浓度幂之积的比,因此该反应的化学方程式为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
①N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
②C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
③2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol
2×②-①-③,整理可得2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=–746.5kJ/mol;
N2(g)+2CO2(g) △H=–746.5kJ/mol;
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该溶液得到较浓的硝酸,是由于亚硝酸电离产生NO2-在阳极失去电子,发生氧化反应,电极反应式为:HNO2-2e-+H2O=NO3-+3H+;
(3)NH4NO3是强酸弱碱盐,在溶液中由于NH4+水解使溶液显酸性,向该溶液中通入氨气,导致c(NH3H2O)增大,导致化学平衡NH4++H2O![]() NH3H2O+H+逆向移动;若溶液显中性,则c(OH-)=10-7mol/L,c(NH4+)=
NH3H2O+H+逆向移动;若溶液显中性,则c(OH-)=10-7mol/L,c(NH4+)=![]() mol/L,c(NH3H2O)=
mol/L,c(NH3H2O)=![]() mol/L,K=
mol/L,K=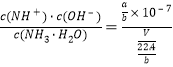 =2.0×10-5,解得V=
=2.0×10-5,解得V=![]() 或0.112a;
或0.112a;
(4)①根据图像可知:无论是在什么温度下,当温度超过900℃时NO脱除率都会骤然下降,是由于反应4NH3+6NO![]() 5N2+6H2O的正反应是在催化剂存在时进行,催化剂只有在一定温度范围内催化活性才最强,当温度超过900℃时NO脱除率都会骤然下降的原因是催化剂活性下降;
5N2+6H2O的正反应是在催化剂存在时进行,催化剂只有在一定温度范围内催化活性才最强,当温度超过900℃时NO脱除率都会骤然下降的原因是催化剂活性下降;
②曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,根据图象,NO的脱除率从55%上升到75%,则该段时间内NO的脱除量为△c=6×10-4mg/m3×(75%-55%)=1.2×10-4mg/m3,时间间隔为△t=0.8s,所以该段时间内NO的脱除速率为v=![]() =1.5×10-4 mg/(m3·s);
=1.5×10-4 mg/(m3·s);
③两种反应物存在的反应,增大一种反应物的量可提高另一种反应物的转化率,根据图象,曲线c的NO脱除率最低,即NO的转化率最低,所以NO的在总反应物中的比例最高,符合的是n(NH3):n(NO)的物质的量之比1:3。