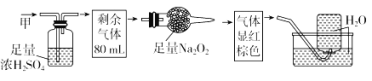
��Ŀ����
����Ŀ����������ǧ��ƵĻ�ѧ���ʼ������������෨�����ü�����������ġ�
��1������7���� ![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ����____�ֺ��أ�����____��Ԫ�أ�����
����____�ֺ��أ�����____��Ԫ�أ����� ![]() ��
��![]() ��____��____����Ϊ____��
��____��____����Ϊ____��![]() ��
��![]() ������ͬ��____��
������ͬ��____��
��2����������8�����ʣ��� Cu �� BaSO4���塡�����ڵ�NaCl ��Fe(OH)3���� �ݴ����ᡡ��CO2�������� ��ʯ��ˮ
�����ڻ�������(����ţ���ͬ)____��
���ܵ���ĵ�����____��
�����ڵ���ʵ���____��
�����ڷǵ���ʵ���____��
���𰸡�5 4 ![]()
![]() ͬλ�� ������ �ܢ� �� �ڢۢ� ��
ͬλ�� ������ �ܢ� �� �ڢۢ� ��
��������
��1��Ԫ�ؾ��Ǿ�����ͬ�ĺ˵����������������������һ��ԭ�ӵ��ܳƣ�������ָ����һ����Ŀ���Ӻ�һ����Ŀ���ӵ�һ��ԭ�ӣ�������ͬ����������ͬ������ͬһԪ�صIJ�ͬ���ػ�Ϊͬλ�أ�![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ����5�ֺ��أ�����H��C��N��O��4��Ԫ�أ�
����5�ֺ��أ�����H��C��N��O��4��Ԫ�أ�![]() ��
��![]() ��
��![]() ��
��![]() ��Ϊͬλ�أ�
��Ϊͬλ�أ�![]() ��
��![]() ������ͬ��ԭ����������
������ͬ��ԭ����������
��2����Cu�ǵ��ʣ��Ǵ�����ܵ��磬�Ȳ��ǵ���ʣ�Ҳ���Ƿǵ���ʣ�
��BaSO4�����Ǵ����Ļ��������״̬���ܵ��磬���ڵĵ���ʣ�
�����ڵ�NaCl�Ǵ����Ļ����ˮ��Һ�л�����״̬���ܵ��磬���ڵĵ���ʣ�
��Fe(OH)3�����ǻ����Ȳ��ǵ���ʣ�Ҳ���Ƿǵ���ʣ�
�ݴ������Ǵ����ˮ��Һ���ܵ��磬���ڵĵ���ʣ�
��CO2�Ǵ�������ڷǵ���ʣ����������̼���ܵ��磻
�������ǵ��ʣ��Ǵ���������磬�Ȳ��ǵ���ʣ�Ҳ���Ƿǵ���ʣ�
��ʯ��ˮ�ǻ����ܵ��磻
�ʴ�Ϊ���ܢࣻ�٣��ڢۢݣ��ޡ�

 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�