题目内容
13.主族元素X、Y、Z的离子为aX+、bY2-、cZ-,半径大小关系是X+<Z-<Y2-下列说法错误的是( )| A. | Y2-的还原性大于Z? | B. | 单质的还原性Z>Y | ||
| C. | b一定小于c | D. | X、Y可处于同周期或X在Y的下周期 |
分析 三种离子的核外电子排布不一定相等,则离子半径cZ-<bY2-,Y、Z可位于同一周期或不同周期,位于同一周期时b小于c,位于不同周期时,b大于c,离子半径aX+<cZ-<bY2-,处于相同周期时,或X位于Y的上一周期时,aX+<bY2-,X位于Y的下一周期时,核外电子排布相同,核电核数越大,半径越小,则aX+<bY2-,根据元素的非金属性的强弱比较离子或单质的还原性.
解答 解:A.位于同一周期时b小于c,Z的非金属性较强,对应离子的还原性较弱,位于不同周期时,b大于c,仍是Z的非金属性较强,对应离子的还原性较弱,所以Y2-的还原性大于Z?,故A正确;
B.位于同一周期时b小于c,Z的非金属性较强,Z的还原性较弱,位于不同周期时,b大于c,仍是Z的非金属性较强,Z的还原性较弱,则Z单质的还原性小于X,故B错误;
C.三种离子的核外电子排布不一定相等,则离子半径cZ-<bY2-,Y、Z可位于同一周期或不同周期,位于同一周期时b小于c,位于不同周期时,b大于c,故C错误;
D.离子半径aX+-<bY2-,处于相同周期,或X位于Y的上一周期,aX+<bY2-,X位于Y的下一周期时,核外电子排布相同,核电核数越大,半径越小,则aX+<bY2-,故D正确.
故选BC.
点评 本题考查元素位置结构性质的相互关系应用,题目难度较大,注意题目没有告诉三种离子核外电子排布是否相同这一点.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目
3.设NA代表阿佛加德罗常数,下列说法中正确的是( )
| A. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为8NA | |
| C. | 0.44g C3H8中含有的共用电子对总数目为0.08NA | |
| D. | 常温常压下,100 mL 0.5 mol/L 的乙酸溶液中,乙酸的分子数目为0.05NA |
1.下列解释事实的化学方程式或离子方程式正确的是( )
| A. | 向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| B. | 将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O→2C6H5OH+SO32- | |
| C. | 用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O | |
| D. | 工业上可用电解法制备Mg:2MgO$\frac{\underline{\;熔融\;}}{电解}$2Mg+O2↑ |
8.用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
| A. | 常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA | |
| B. | 标准状况下,22.4L四氯化碳中所含有的Cl原子数目为4NA | |
| C. | 标准状况下,22.4升H2O中所含分子数大于NA | |
| D. | 常温常压下,33.6L氯气与56 g铁充分反应,转移的电子数为3NA |
18.下列实验操作或事实与预期实验目的或所得结论对应正确的是( )
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 | 说明原溶液中一定含有FeCl3 |
| B | 白色Mg(OH)2 $\stackrel{CuSO_{4}溶液}{→}$蓝色Cu(OH)2 | Mg(OH)2的溶度积大于Cu(OH)2 |
| C | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀 | 酸雨中一定含有SO42- |
| D | H3PO3+2HaOH(足量)═Na2HPO2+2H2O | H3PO3属于三元酸 |
| A. | A | B. | B | C. | C | D. | D |
5.SO2能使品红溶液褪色,体现了SO2的( )
| A. | 酸性氧化物的性质 | B. | 漂白性 | ||
| C. | 氧化性 | D. | 还原性 |
2.假设R元素无同位素,元素R原子的质量数为A,假设R元素无同位素,元素R原子的质量数为A,Rm-的核外电子数为x,则WgRm-离子所含中子的物质的量为( )
| A. | (A-x+m)mol | B. | (A-x-m)mol | C. | $\frac{W}{A}$(A-x+m)mol | D. | $\frac{W}{A}$(A-x-m)mol |


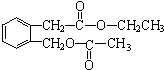 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$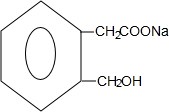 +CH3COONa+CH3CH2OH+H2O;反应类型是水解反应(或取代反应);
+CH3COONa+CH3CH2OH+H2O;反应类型是水解反应(或取代反应);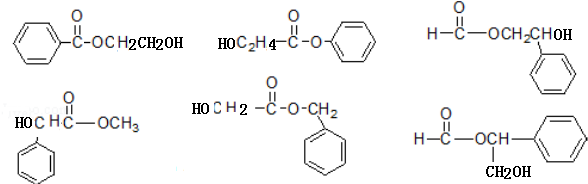 (任写两个).
(任写两个).