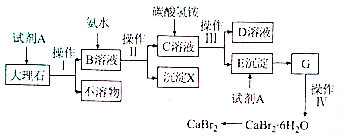
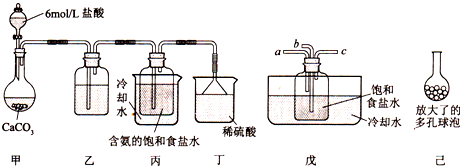
题目内容
5.SO2能使品红溶液褪色,体现了SO2的( )| A. | 酸性氧化物的性质 | B. | 漂白性 | ||
| C. | 氧化性 | D. | 还原性 |
分析 二氧化硫能和有色物质反应生成无色物质而具有漂白性,二氧化硫还具有氧化性、还原性,据此分析解答.
解答 解:二氧化硫能和品红溶液生成无色物质而使品红溶液褪色,该现象体现二氧化硫的漂白性,与二氧化硫酸性氧化物的性质、氧化性和还原性无关,故选B.
点评 本题考查二氧化硫的性质,二氧化硫具有漂白性、氧化性和还原性,但二氧化硫不能漂白酸碱指示剂,为易错点.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
15.在常温条件下,下列对醋酸的叙述中,不正确的是( )
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,$\frac{{cCH}_{3}COOH}{{cH}^{+}}$变小 | |
| C. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-) | |
| D. | 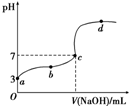 向10.00 mL 0.1 mol•L-1HCOOH溶液中逐滴加入0.1 mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化),则c点NaOH溶液的体积小于10 mL 向10.00 mL 0.1 mol•L-1HCOOH溶液中逐滴加入0.1 mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化),则c点NaOH溶液的体积小于10 mL |
16.常温下,下列溶液中的pH判断或各微粒浓度关系,不正确的是( )
| A. | 将5mL0.02mol/L的H2SO4溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2 | |
| B. | 将0.2mol/L的某一元酸HA溶液和0.1mol/LNaOH溶液等体积混合,混合液pH大于7,则反应后的混合液中:c(OH-)+c(A-)>c(H+)+c(HA) | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | 常温下,0.1mol/L的CH3COONa和NaClO的混合溶液中:c(OH-)-c(H+)=c(HClO)+c(CH3COOH) |
13.主族元素X、Y、Z的离子为aX+、bY2-、cZ-,半径大小关系是X+<Z-<Y2-下列说法错误的是( )
| A. | Y2-的还原性大于Z? | B. | 单质的还原性Z>Y | ||
| C. | b一定小于c | D. | X、Y可处于同周期或X在Y的下周期 |
20.下表是元素周期表的一部分,请回答下列问题:
(1)写出下列元素符号:①N,⑥Si
(2)在这些元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式)
(3)在这些元素中,原子半径最大的是Na(填元素符号)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)在这些元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式)
(3)在这些元素中,原子半径最大的是Na(填元素符号)
14. 某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
①取少量该溶液加NaOH溶液共热,产生刺激性气味的气体,未观察到其它明显现象;
②另取少量该溶液加足量的硝酸,可观察到红棕色气体,未观察到沉淀生成.
根据上述实验,以下说法正确的是( )
 某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:①取少量该溶液加NaOH溶液共热,产生刺激性气味的气体,未观察到其它明显现象;
②另取少量该溶液加足量的硝酸,可观察到红棕色气体,未观察到沉淀生成.
根据上述实验,以下说法正确的是( )
| A. | 由实验①只能确定原溶液中一定有NH4+,没有Fe2+. | |
| B. | 取实验②后的溶液滴加淀粉溶液,可能变蓝色. | |
| C. | 原溶液中可能含有NH4+、Na+、SO32-、I-四种离子 | |
| D. | 取少量原溶液加酸性高锰酸钾溶液,可能有两种离子被氧化 |