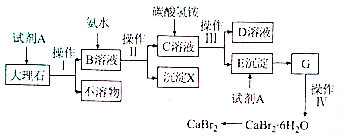
题目内容
2.假设R元素无同位素,元素R原子的质量数为A,假设R元素无同位素,元素R原子的质量数为A,Rm-的核外电子数为x,则WgRm-离子所含中子的物质的量为( )| A. | (A-x+m)mol | B. | (A-x-m)mol | C. | $\frac{W}{A}$(A-x+m)mol | D. | $\frac{W}{A}$(A-x-m)mol |
分析 在阴离子中,阴离子的核外电子数=质子数+电荷数,质量数=质子数+中子数,所以中子数=质量数-质子数=核外电子数-电荷数.
解答 解:Rm-离子有x个电子,电荷数为m,阴离子的核外电子数=质子数+电荷数,所以质子数=核外电子数-电荷数=x-m;中子数=质量数-质子数=A-(x-m)=A-x+m,
离子的物质的量为$\frac{W}{A}$mol,则中子的物质的量为$\frac{W}{A}$(A-x+m)mol,
故选C.
点评 本题考查了核外电子数、质子数、中子数、质量数、电荷数之间的关系,难度不大,明确由原子变成离子,变化的是核外电子数,不变的是核内质子数.

练习册系列答案
相关题目
13.主族元素X、Y、Z的离子为aX+、bY2-、cZ-,半径大小关系是X+<Z-<Y2-下列说法错误的是( )
| A. | Y2-的还原性大于Z? | B. | 单质的还原性Z>Y | ||
| C. | b一定小于c | D. | X、Y可处于同周期或X在Y的下周期 |
7.(1)人们常用催化剂来选择反应进行的方向.如图1所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
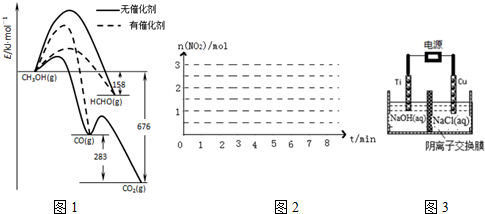
①写出1moL HCHO生成CO的热化学方程式:HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)△H=-235KJ•mol-1.
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能.
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10L定容容器中发生反应2N2H4(g)+2NO2(g)?3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是abd.
a.混合气体密度保持不变
b.3v正(NO2)=2v逆(N2)
c.N2H4与NO2体积比保持不变
d.体系压强保持不变
②在某温度下,5L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
请画出该反应中n(NO2)随时间变化曲线,并画出在第7min分别升温、加压、加催化剂的情况下n(NO2)随时间变化示意图如图2.计算该温度下反应的平衡常数K(保留2位有效数字,写出计算过程).
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑,如图3所示.该电解池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.

①写出1moL HCHO生成CO的热化学方程式:HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)△H=-235KJ•mol-1.
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能.
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10L定容容器中发生反应2N2H4(g)+2NO2(g)?3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是abd.
a.混合气体密度保持不变
b.3v正(NO2)=2v逆(N2)
c.N2H4与NO2体积比保持不变
d.体系压强保持不变
②在某温度下,5L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/mol 时间 | n (N2H4) | n (NO2) | n (N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑,如图3所示.该电解池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
14. 某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
①取少量该溶液加NaOH溶液共热,产生刺激性气味的气体,未观察到其它明显现象;
②另取少量该溶液加足量的硝酸,可观察到红棕色气体,未观察到沉淀生成.
根据上述实验,以下说法正确的是( )
 某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:①取少量该溶液加NaOH溶液共热,产生刺激性气味的气体,未观察到其它明显现象;
②另取少量该溶液加足量的硝酸,可观察到红棕色气体,未观察到沉淀生成.
根据上述实验,以下说法正确的是( )
| A. | 由实验①只能确定原溶液中一定有NH4+,没有Fe2+. | |
| B. | 取实验②后的溶液滴加淀粉溶液,可能变蓝色. | |
| C. | 原溶液中可能含有NH4+、Na+、SO32-、I-四种离子 | |
| D. | 取少量原溶液加酸性高锰酸钾溶液,可能有两种离子被氧化 |
6.醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,下列叙述正确的是( )
| A. | CH3COOH溶液中加少量的CH3COONa固体,平衡正向移动 | |
| B. | 0.10 mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 | |
| C. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后溶液的pH>7 |
7.如图所示是四种常见有机物的比例模型示意图.下列说法正确的是( )
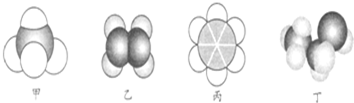

| A. | 22.4 L甲中含有10 mol电子 | |
| B. | 乙与乙的加聚产物都能使溴水褪色 | |
| C. | 丙不能与溴水、酸性高锰酸钾溶液发生反应 | |
| D. | 丙、丁都可以萃取溴水中的溴单质 |
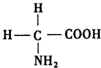 氨基酸是蛋白质的基石,甘氨酸是最简单的氨基酸(结构如图),在甘氨酸分子中,N原子的杂化形式是sp3,在甘氨酸分子中C、N、O原子的第一电离能从大到小的顺序是N>O>C;氮可以形成多种离子,如N3-、NH2-、NH4+、N2H5+等,其中,NH4+的空间构型是正四面体.
氨基酸是蛋白质的基石,甘氨酸是最简单的氨基酸(结构如图),在甘氨酸分子中,N原子的杂化形式是sp3,在甘氨酸分子中C、N、O原子的第一电离能从大到小的顺序是N>O>C;氮可以形成多种离子,如N3-、NH2-、NH4+、N2H5+等,其中,NH4+的空间构型是正四面体.