题目内容
1.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KN03→K20+5Na20+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )| A. | 生成40.0 L N2(标准状况) | |
| B. | 有0.250 mol KN03被氧化 | |
| C. | 转移电子的物质的量为1.25 mol | |
| D. | 被氧化的N原子的物质的量为2.5mol |
分析 10NaN3+2KN03→K20+5Na20+16N2↑中,N元素由+5价降低为0,反应中共转移10电子,若氧化产物比还原产物多1.75mol,由反应可知,生成16molN2时氧化产物比还原产物多14mol,则该反应生成氮气为$\frac{16×1.75}{14}$=2mol,以此来解答.
解答 解:10NaN3+2KN03→K20+5Na20+16N2↑中,N元素由+5价降低为0,反应中共转移10电子,若氧化产物比还原产物多1.75mol,由反应可知,生成16molN2时氧化产物比还原产物多14mol,则该反应生成氮气为$\frac{16×1.75}{14}$=2mol,
A.生成标况下氮气的体积为2mol×22.4L/mol=44.8L,故A错误;
B.由反应可知,被还原的硝酸钾的物质的量为2mol×$\frac{2}{16}$=0.25mol,故B错误;
C.转移电子的物质的量为0.25mol×(5-0)=1.25mol,故C正确;
D.转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为$\frac{1.25×30}{10}$=3.75mol,故D错误;
故选C.
点评 本题以信息的形式考查氧化还原反应,明确发生的反应及反应中元素的化合价变化即可解答,题目难度不大,注意将N3-作为整体来分析是解答的难点.

练习册系列答案
相关题目
1.如图是研究铁钉腐蚀的装置图,下列说法正确的是( )
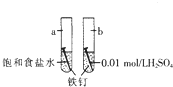

| A. | a是吸氧腐蚀,b是化学腐蚀 | |
| B. | a的负极反应时Fe-3e-═Fe3+ | |
| C. | a、b两处铁钉用导线联通有电流通过 | |
| D. | b前期发生析氢腐蚀,后期发生吸氧腐蚀 |
18.100g样品所消耗的溴的毫克数称为溴指数.溴指数越高,则说明样品中不饱和烃含量越高.我国石油工业一般利用恒定电流库仑分析法测定汽油的溴指数,利用电解产生的溴与不饱和烃反应,支持电解质为LiBr,溶剂仅含5%的水,其余为甲醇,苯与醋酸.下列有关说法正确的是( )
| A. | 在溶剂中提高苯的比例,能提高溶液的导电性 | |
| B. | 电解时阳极的电极反应式为2Br--2e-=Br2 | |
| C. | 电解时可用铁作阳极材料 | |
| D. | 汽油样品应加在阴极区 |
5.几种短周期元素的原子半径及主要化合价如表所示:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5.+3.-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | Z的最高价含氧酸分子式为H3ZO4 | |
| C. | Y的最高价氧化物对应的水化物能溶于氢氧化钠溶液 | |
| D. | Z的氢化物比W的氢化物稳定 |
6.下列晶体属于分子晶体的是( )
| A. | 石英 | B. | C60 | C. | NaCl | D. | 金属K |
11.下列各组元素中,属于同一周期的是( )
| A. | Na、Li | B. | N、Cl | C. | Si、S | D. | O、P |
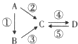 Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.
Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.