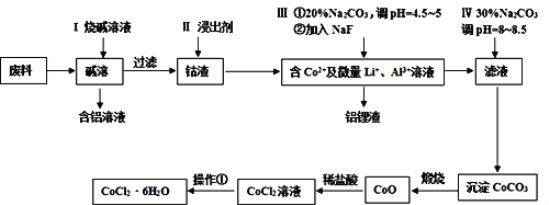
题目内容
【题目】一定压强下,向10 L密闭容器中充入1 mol S2Cl2和1 mol Cl2,发生反应S2Cl2(g)+Cl2(g) ![]() 2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中不正确的是( )
2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中不正确的是( )
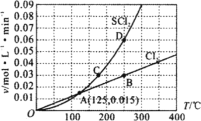
A.正反应的活化能大于逆反应的活化能
B.达到平衡后再加热,平衡向逆反应方向移动
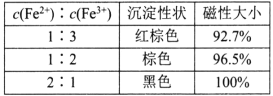
C.A、B、C、D四点对应状态下,达到平衡状态的为B、D
D.一定温度下,在恒容密闭容器中,达到平衡后缩小容器体积,重新达到平衡后,Cl2的平衡转化率不变
【答案】A
【解析】
根据反应S2Cl2 (g) +Cl2 (g)![]() 2SCl2 (g)可知,用氯气的消耗速率表示正反应速率和用SCl2的消耗速率表示逆反应速率,二者之比为1:2时转化为用同一种物质表示的正逆反应速率相等,达到平衡状态,由图像可知B、D点时的正逆反应速率之比为1:2,达到平衡状态;B、D点为平衡点,由图中数据可知,B、D点的状态对应的温度为250℃,300℃时,SCl2的消耗速率大于氯气的消耗速率的2倍,说明平衡逆向移动,则正反应为放热反应,ΔH2<0。
2SCl2 (g)可知,用氯气的消耗速率表示正反应速率和用SCl2的消耗速率表示逆反应速率,二者之比为1:2时转化为用同一种物质表示的正逆反应速率相等,达到平衡状态,由图像可知B、D点时的正逆反应速率之比为1:2,达到平衡状态;B、D点为平衡点,由图中数据可知,B、D点的状态对应的温度为250℃,300℃时,SCl2的消耗速率大于氯气的消耗速率的2倍,说明平衡逆向移动,则正反应为放热反应,ΔH2<0。
A. 正反应的活化能是发生反应所需要的能量,逆反应的活化能是反应中又释放出的能量,正反应的活化能减去逆反应的活化能就等于总反应的吸热放热量,由分析可知ΔH<0,正反应为放热反应,所以正反应的活化能小于逆反应的活化能,故A错误;
B. 由分析可知ΔH<0,正反应为放热反应,加热后平衡向逆反应方向移动,故B正确;
C. 根据反应S2Cl2 (g) +Cl2 (g)![]() 2SCl2 (g)可知,用氯气的消耗速率表示正反应速率和用SCl2的消耗速率表示逆反应速率,二者之比为1:2时转化为用同一种物质表示的正逆反应速率相等,达到平衡状态,由图像可知B、D点时的正逆反应速率之比为1:2,达到平衡状态;B、D点为平衡点,故C正确;
2SCl2 (g)可知,用氯气的消耗速率表示正反应速率和用SCl2的消耗速率表示逆反应速率,二者之比为1:2时转化为用同一种物质表示的正逆反应速率相等,达到平衡状态,由图像可知B、D点时的正逆反应速率之比为1:2,达到平衡状态;B、D点为平衡点,故C正确;
D. 根据反应S2Cl2 (g) +Cl2 (g)![]() 2SCl2 (g)反应物和产物都是气体,且反应物和产物的系数相等,所以改变压强不改变平衡移动,缩小容器体积,重新达到平衡后,Cl2的平衡转化率不变,故D正确;
2SCl2 (g)反应物和产物都是气体,且反应物和产物的系数相等,所以改变压强不改变平衡移动,缩小容器体积,重新达到平衡后,Cl2的平衡转化率不变,故D正确;
答案选A。

 阅读快车系列答案
阅读快车系列答案