题目内容
15.下列离子方程式正确的是( )| A. | Na投入足量盐酸中:2Na+2H2O=2Na++2OH-+H2↑ | |
| B. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| C. | 向Na2CO3溶液中加入少量盐酸:CO32-+2H+=H2O+CO2↑ | |
| D. | NaHCO3溶液中加入过量澄清石灰水:Ca2++HCO3-+OH-=H2O+CaCO3↓ |
分析 A.Na与盐酸反应生成氯化钠和氢气;
B.生成盐酸和HClO,HClO在离子反应中保留化学式;
C.反应生成NaHCO3;
D.NaHCO3完全反应,反应生成碳酸钙、水、NaOH.
解答 解:A.Na投入足量盐酸中的离子反应为2Na+2H+=2Na++H2↑,故A错误;
B.Cl2通入水中的离子反应为Cl2+H2O=H++Cl-+HClO,故B错误;
C.向Na2CO3溶液中加入少量盐酸的离子反应为CO32-+H+=HCO3-,故C错误;
D.NaHCO3溶液中加入过量澄清石灰水的离子反应为Ca2++HCO3-+OH-=H2O+CaCO3↓,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
6.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 2L0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 1molNa2O2固体中含离子总数为4NA | |
| D. | 丙烯(CH2=CH-CH3)和环丙烷组成的42g混合气体中氢原子的个数为6NA |
3.下列实验不能达到目的是( )
| A. | 将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水具有漂白性 | |
| B. | 向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 | |
| C. | 将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝的熔点高于铝 | |
| D. | 向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了反应而成碱性 |
10.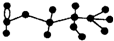 某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
①水解 ②加聚 ③取代 ④消去 ⑤银镜( )
 某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有①水解 ②加聚 ③取代 ④消去 ⑤银镜( )
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ①③④ | D. | ①④⑤ |
20.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 17g氨气中所含原子数为NA | |
| B. | 标准状况下,1 L水中所含分子数为122.4NA | |
| C. | 0.3 mol/L的MgCl2溶液中含Mg2+数目0.3 NA | |
| D. | 常温常压下,16 g O2含有的氧原子数为NA |
4.下列说法正确的是( )
| A. | 所有物质中均存在化学键 | |
| B. | 非金属元素间形成的化合物一定是共价化合物 | |
| C. | 离子化合物中可能含非极性共价键 | |
| D. | 有共价键的化合物一定是共价化合物 |
5.常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是( )
| A. | pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
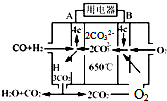 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.