题目内容
10.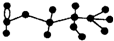 某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有①水解 ②加聚 ③取代 ④消去 ⑤银镜( )
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ①③④ | D. | ①④⑤ |
分析 由有机物球棍模型可知有机物结构简式为HCOOCH2CHOHCH3,含有酯基,可水解,含有醛基,可发生银镜反应,含有羟基,可发生取代、消去和氧化反应,以此解答.
解答 解:由有机物球棍模型可知有机物结构简式为HCOOCH2CHOHCH3,含有酯基,可水解,含有醛基,可发生银镜反应,含有羟基,可发生取代、消去和氧化反应,只有①③④⑤正确.
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力和有机物知识的综合运用,难度不大,注意把握有机物的官能团的性质,为解答该题的关键.

练习册系列答案
相关题目
20.设NA为阿伏伽德罗常数的值.下列说法正确的是(相对原子量:N-14 H-1)( )
| A. | 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 | |
| B. | 标准状况下,2.24L H2O中含有H2O分子数为0.1NA | |
| C. | 1L 0.1mol/L NaHSO4溶液中含有的阳离子数目为0.1NA | |
| D. | 实验室所制得的1.7g NH3中含有的电子数为NA |
1.“类推”是思维的一种形式,但往往也有不对的,下列“类推”中正确的是( )
| A. | Fe、Cu连接插在稀硫酸中形成的原电池,Fe为负极;那么Fe、Cu连接插在浓硝酸溶液中形成的原电池,Fe也为负极 | |
| B. | HBr的沸点比HCl高,那么HCl的沸点比HF高 | |
| C. | 硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解,那么浓硝酸溶液也要保存在棕色试剂瓶中 | |
| D. | 镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁 |
18.将40mL 0.2mol/L NaOH溶液和20mL0.2mol/L的CH3COOH溶液混和,充分反应后蒸干并加强热,最终得到的固体是( )
| A. | Na2CO3 | B. | CH3COONa | ||
| C. | NaOH和CH3COONa的混合物 | D. | NaOH |
5.下列有关实验操作、现象或结论的叙述正确的是( )
| A. | 乙醇的催化氧化实验中铜丝主要起氧化剂的作用 | |
| B. | 用钠可以检验某无水酒精中是否含有水 | |
| C. | 制取乙烯时,温度计水银球置位于液面以下 | |
| D. | 除去甲烷中混有的少量乙烯,可以将混合气体通过酸性KMnO4溶液 |
15.下列离子方程式正确的是( )
| A. | Na投入足量盐酸中:2Na+2H2O=2Na++2OH-+H2↑ | |
| B. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| C. | 向Na2CO3溶液中加入少量盐酸:CO32-+2H+=H2O+CO2↑ | |
| D. | NaHCO3溶液中加入过量澄清石灰水:Ca2++HCO3-+OH-=H2O+CaCO3↓ |
2. 已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中正确的是( )
已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中正确的是( )
 已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中正确的是( )
已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中正确的是( )| A. | 还原性:Fe2+>I->Br- | |
| B. | 当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| C. | 原混合溶液中FeBr2的物质的量为6mol | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
19.某同学按如图所示的装置进行试验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交换膜处SO42-从右向左移动.下列分析错误的是( )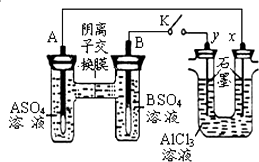

| A. | 金属活动性A强于B | |
| B. | 反应初期,y电极的电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 反应初期,x电极周围出现白色沉淀,后来电极附近沉淀溶解 | |
| D. | 电解一段时间后将AlCl3溶液倒入烧杯并搅拌可得到偏铝酸盐溶液 |
20.正确掌握化学用语是学好化学的基础.下列化学用语中正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | B. | 6个中子的碳原子的符号:12C | ||
| C. | Cl-的结构示意图: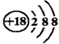 | D. | NaCl的电子式: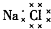 |