题目内容
【题目】已知在稀溶液里,强酸跟强碱发生中和反应生成1 mol液态水时反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:
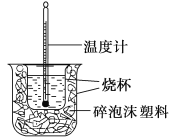
(1)图中未画出的实验器材是________________、________________。
(2)做一次完整的中和热测定实验,温度计需使用________次。
(3)实验时,将0.50 mol·L-1的盐酸加入到0.55mol·L-1的NaOH溶液中,两种溶液的体积均为50 mL,各溶液的密度均为1 g /cm3,生成溶液的比热容c=4.18 J /(g· oC),实验的起始温度为t1 oC,终止温度为t2 oC。测得温度变化数据如下:
序号 | 反应物 | 起始温度t1/ oC | 终止温度t2/ oC | 中和热 |
① | HCl+NaOH | 14.8 | 18.3 | ΔH1 |
② | HCl+NaOH | 15.1 | 19.7 | ΔH1 |
③ | HCl+NaOH | 15.2 | 18.5 | ΔH1 |
④ | HCl+NH3·H2O | 15.0 | 18.1 | ΔH2 |
①试计算上述两组实验测出的中和热ΔH1=______________。
②某小组同学为探究强酸与弱碱的稀溶液反应时的能量变化,又多做了一组实验④,用0.55mol·L-1的稀氨水代替NaOH溶液,测得温度的变化如表中所列,试计算反应的ΔH2=____________。
③两组实验结果差异的原因是___________________________________________。
④写出HCl+NH3· H2O反应的热化学方程式:_______________________________________。
【答案】硬纸板(或泡沫塑料板) 环形玻璃搅拌棒 3 -56.8kJ/mol -51.8kJ/mol NH3·H2O是弱碱,在中和过程中NH3·H2O发生电离,要吸热,因而总体放热较少 HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l) ΔH=-51.8 kJ·mol-1
【解析】
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒和烧杯上方的泡沫塑料盖;
(2)中和热的测定中,需要测出反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度,所以总共需要测量3次;
(3)①浓度为0.5mol/L的酸溶液和0.55mol/L的碱溶液各50mL混合,反应生成了0.025mol水,混合后溶液的质量和为:m=100mL×1g/mL=100g,c=4.18J/(g·℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g·℃)×100g×3.4℃=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为△H1=1.4212kJ×![]() =56.8kJ;中和热为:-56.8KJ/mol;
=56.8kJ;中和热为:-56.8KJ/mol;
②△H2=cm△T=4.18J/(g·℃)×100g×3.1℃=1.2958kJ;即生成0.025mol的水放出热量1.2958kJ,所以生成1mol的水放出热量为△H2=1.2958kJ×![]() =51.8KJ;中和热-51.8KJ/mol;
=51.8KJ;中和热-51.8KJ/mol;
③两组实验结果差异的原因是:一水合氨为弱碱,在中和过程中一水合氨发生电离,要吸收热量,因而总体放热较少;
③盐酸与一水合氨反应生成氯化铵和水,HCl+NH3·H2O的热化学方程式:HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l)△H=-51.8kJ/mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】已知25℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数/ mol/ L | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列说法正确的是
A. 等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
B. 将等浓度的 HA溶液与NaA溶液等体积混合,混合液中:c(A-)<c(Na+)
C. 向 Na2B溶液中加入足量的 HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D. NaHB溶液中部分微粒浓度的关系为:c(Na+)=c(HB-) +c(H2B)+c(B2-)