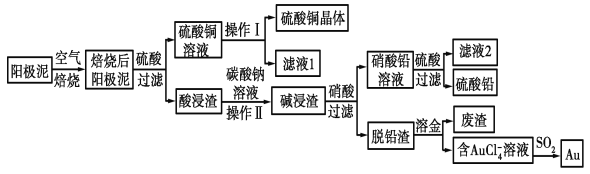
题目内容
【题目】某主族元素R的最高正化合价与负化合价代数和为6,下列叙述正确的是( )
A. R是第ⅦA族元素
B. R的最高价氧化物为RO3
C. R的气态氢化物是可燃性气体
D. R的气态氢化物易溶于水显碱性
【答案】A
【解析】
A.某主族元素R的最高正化合价与负化合价代数和为6,说明该元素的最高正价为+7,为第ⅦA族元素,故A正确;
B.R的最高价为+7价,氧化物为R2O7,故B错误;
C.卤化氢不属于可燃性气体,故C错误;
D.卤化氢溶于水显酸性,故D错误。
故答案选A。

【题目】高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。
(资料)K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。
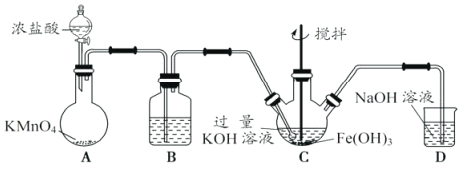
①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为___________。
②除杂装置B中的试剂为___________。
③C为制备K2FeO4装置,KOH溶液过量的原因是___________。
④D为尾气处理装置,发生反应的离子方程式为___________。
(2)探究 K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黃绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案I中溶液变红可知a中含有___________。该离子的产生___________(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________。方案Ⅱ得出氧化性:Cl2___________FeO42-(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)________。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________。(计算结果保留到0.1%)
【题目】已知在稀溶液里,强酸跟强碱发生中和反应生成1 mol液态水时反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:

(1)图中未画出的实验器材是________________、________________。
(2)做一次完整的中和热测定实验,温度计需使用________次。
(3)实验时,将0.50 mol·L-1的盐酸加入到0.55mol·L-1的NaOH溶液中,两种溶液的体积均为50 mL,各溶液的密度均为1 g /cm3,生成溶液的比热容c=4.18 J /(g· oC),实验的起始温度为t1 oC,终止温度为t2 oC。测得温度变化数据如下:
序号 | 反应物 | 起始温度t1/ oC | 终止温度t2/ oC | 中和热 |
① | HCl+NaOH | 14.8 | 18.3 | ΔH1 |
② | HCl+NaOH | 15.1 | 19.7 | ΔH1 |
③ | HCl+NaOH | 15.2 | 18.5 | ΔH1 |
④ | HCl+NH3·H2O | 15.0 | 18.1 | ΔH2 |
①试计算上述两组实验测出的中和热ΔH1=______________。
②某小组同学为探究强酸与弱碱的稀溶液反应时的能量变化,又多做了一组实验④,用0.55mol·L-1的稀氨水代替NaOH溶液,测得温度的变化如表中所列,试计算反应的ΔH2=____________。
③两组实验结果差异的原因是___________________________________________。
④写出HCl+NH3· H2O反应的热化学方程式:_______________________________________。