题目内容
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )
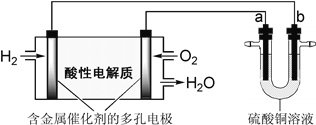
A. 燃料电池工作时,正极反应为:O2+ 2H2O + 4e-= 4OH-
B. 若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. 若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D. 若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
【答案】D
【解析】
试题A、原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。所以氢气在负极通入,氧气在正极通入。又因为溶液显酸性,所以正极电极反应式是O2+4H++4e-=2H2O,A不正确;B、a电极与电源的正极相连,作阳极,所以铁失去电子,a电极被溶解。B电极是阴极,d电极上有铜析出,B不正确;C、若a、b极都是石墨,则a电极是溶液中的 OH-放电放出氧气。根据电子得失守恒可知,a电极产生的氧气是电池中消耗的H2体积的![]() ,C不正确;D、若a极是粗铜,b极是纯铜,则相当于是粗铜的提纯,因此a极逐渐溶解,b极上有铜析出,D正确,答案选D。
,C不正确;D、若a极是粗铜,b极是纯铜,则相当于是粗铜的提纯,因此a极逐渐溶解,b极上有铜析出,D正确,答案选D。

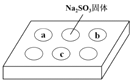
【题目】某同学进行SO2的性质实验。在点滴板a、b、c处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如下表所示。
序号 | 试剂 | 实验现象 |
|
a | 品红溶液 | 红色褪去 | |
b | 酸性KMnO4溶液 | 紫色褪去 | |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
下列说法正确的是
A. 浓硫酸与Na2SO3固体发生了氧化还原反应
B. a、b均表明SO2具有漂白性
C. c中只可能发生反应:SO2+ 2OH—= SO32—+ H2O
D. c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+) = 2c(SO32—) +c(HSO3) + c(OH)